在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:
2X(g)+Y(g) 2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
(1)平衡时Z的物质的量为___________;若反应经历5min达到平衡,则Y的平均反应速率为____________。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图像如图甲。
A.升温 B.降温 C.加压 D.减压 E.加催化剂
若c=0.90mol,t1时刻改变的条件是_________(填选项编号,下同),t2_______5min (填“>”,“<”或“=”下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量______0.9mol (填“>”,“<”或“=”)。
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
①A、B两点Z物质正反应速率的大小关系是_________;
②温度T<T0时,Z%逐渐增大的原因是______________。
碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧原子的5倍。
⑴ 求A的分子式
⑵一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是 ,其官能团的名称是
,其官能团的名称是
②A不能发生的反应是(填写序号字母)
a.取代反应b.消去反应c.酯化反应d.还原反应
⑶写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式:
⑷ A还有另一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是
⑸ 已知环氧氯丙烷可与乙二醇发生如下聚合反应: B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是
为测定某有机化合物A的结构,进行如下实验。
Ⅰ.分子式的确定
(1) 将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下)。则该物质分子中碳、氢、氧原子个数比为
(2) 质谱仪测定有机物A的相对分子质量为46,则该物质的分子式是
(3) 根据价键理论,预测 A的可能结构并写出结构简式
A的可能结构并写出结构简式
Ⅱ.结构式 的确定
的确定
(4) 核磁共振氢原子光谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。
例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子(图1)。经测定,有机物A的核磁共振氢谱示意图(图2),则A的结构简式为。
Ⅲ.性质实验
(5) A在一定条件下脱水可生成B,B可合成包装塑料C。体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式
为:
(共10分)
Ⅰ.按要求完成下列问题:
(1) 的名称是。
的名称是。
(2) 的分子式是,分子中手性碳原子有个。
的分子式是,分子中手性碳原子有个。
Ⅱ.下列各化合物中,属于同系物的是(填入编号),属于同分异构体的是。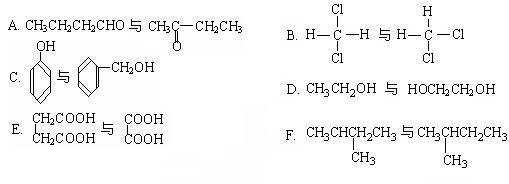
在化学反应中,如果反应前后元素的化合价发生变化,就一定有转移,这类反应就属于反应。元素化合价升高,表示该元素的原子电子,含该元素的物质发生反应,这种物质是剂;元素化合价降低,表明该元素的原子电子,含该元素的物质发生反应,这种物质是剂。
在里或下能导电的化合物叫电解质。电解质溶液之所 以能导电,是由于它们在溶液中发生了,产生了。
以能导电,是由于它们在溶液中发生了,产生了。