设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.1molAl3+离子含有的核外电子数为3NA |
| B.1molCl2与足量的铁反应,转移的电子数为3NA |
| C.10LpH=1的硫酸溶液中含有的H+离子数为2NA |
| D.10LpH=13的NaOH溶液中含有的OH-离子数为NA |
反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率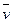 (X)(反应物的消耗速率或产物的生成速率)可表示为
(X)(反应物的消耗速率或产物的生成速率)可表示为
A.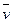 (NH3)=0.010mol•L―1•s―1 (NH3)=0.010mol•L―1•s―1 |
B.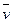 (O2)="0.0010" mol•L―1•s―1 (O2)="0.0010" mol•L―1•s―1 |
C.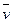 (NO)="0.0010" mol•L―1•s―1 (NO)="0.0010" mol•L―1•s―1 |
D.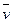 (H2O)="0.045" mol•L―1•s―1 (H2O)="0.045" mol•L―1•s―1 |
决定化学反应速率的根本因素是
| A.温度和压强 | B.参加反应的各物质的性质 | C.反应物的浓度 | D.使用催化剂 |
将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g (A=B)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是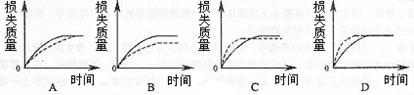
右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸不够了,为使该反应顺利进行,可以从长颈漏斗中加入的试剂是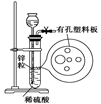
①食盐水②KNO3溶液③适量稀硫酸铜溶液
④Na2CO3溶液⑤CCl4⑥浓氨水
| A.①③⑤ | B.①②③ | C.④⑤⑥ | D.①②③⑤ |
等体积混合0.10 mol·L-1盐酸和0.06 mol·L-1Ba(OH)2溶液后,溶液的pH等于
| A.2.0 | B.12.3 | C.1.7 | D.12.0 |