在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是
A.溶质的质量分数为 |
B.溶质的物质的量浓度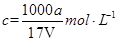 |
C.溶液中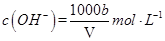 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50 mL 1 mol·L-1的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
| A.75 mL 2 mol·L-1 的NH4Cl | B.150 mL 1 mol·L-1 的NaCl |
| C.50 mL 1.5 mol·L-1 的CaCl2 | D.50 mL 3 mol·L-1 的KClO3 |
O4是意大利的一位科学家合成的一种新型的氧分子,一个分子由四个氧原子构成。振荡会发生爆炸,在大气中含量极少,在相同条件下,等质量的O4和O3比较正确的是
| A.所含原子数相等 | B.分子数之比4:3 |
| C.体积之比1:1 | D.密度之比 1:1 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,22.4 L H2O含有的分子数为NA |
| B.500mL 1moL/L的盐酸溶液中含有的HCl分子数为0.5 NA |
| C.通常状况下, NA个CO2分子占有的体积约为22.4L |
| D.23gNa与O2在不同条件下反应虽分别生成Na2O和Na2O2,但转移的电子数一定为 NA |
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,出现灯泡由亮变暗,至熄灭后又逐渐变亮现象的是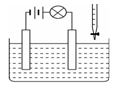
| A.氢氧化钡溶液中逐滴加入硫酸 |
| B.氢氧化钠溶液中逐滴加入硫酸 |
| C.石灰乳中逐滴加入稀盐酸 |
| D.食盐溶液中逐滴加入盐酸 |
下列叙述与胶体的性质无关的是
| A.向氢氧化铁胶体中逐滴加入稀盐酸,开始产生红褐色沉淀,后来沉淀逐渐溶解并消失 |
| B.当日光从窗隙射入暗室时,观察到一束光线 |
| C.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
| D.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘粒子带电荷 |