有如下实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是:
| A.滤液b中不含有Ag+ |
B.浊液a中存在沉淀溶解平衡:AgCl(g) 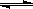 Ag+(aq)+Cl-(aq) Ag+(aq)+Cl-(aq) |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
在一个容积为V L的密闭容器中放入2 L A(g)和1 L B(g),在一定条件下发生下列反应3A(g)十B(g) 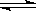 nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g) ,达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
| A.1 | B.2 | C.3 | D.4 |
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |
可逆反应:2NO2 2NO+O2 在密闭容器中反应,达到平衡状态的标志是
2NO+O2 在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |
在一固定容积的密闭容器中加入2LX和3LY气体,发生如下反应:nX(g)+3Y(g)  2R(g)+Q(g)反应达平衡时,测知X和Y的转化率分别为30% 和60%,则化学方程式中的n值为
2R(g)+Q(g)反应达平衡时,测知X和Y的转化率分别为30% 和60%,则化学方程式中的n值为
| A.1 | B.2 | C.3 |
D.4 |
在密闭容器中,对于反应:2SO2(g)+O2(g)  2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为
2SO3(g),SO2和O2起始时分别为20 mol和10 mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为
| A.10 mol和10% | B.20 mol和20% | C.20 mol和40% | D.20 mol和80% |