用固体草酸(化学式为H2C2O4·2H2O)可以制取CO(CO难溶于水),其反应方程式为:H2C2O4·2H2O △ CO↑+CO2↑+3H2O。
(1)若要制得纯净干燥的CO,可将产生的气体通过下图中的两个装置,其导管口的连接顺序是 ;所盛药品依次是 、 。
(2)右图所示装置用于获得均匀稳定气流。下列对其原理分析正确的是 (填数字序号)。
①该装置也可用作暂时储存少量气体的储气装置
②纯净的一氧化碳气体通过该装置纯度不会受影响
③实验中的HCl气体需要稳流,可直接将该装置连入实验中
④当两活塞的开启大小一致时,从Y 端流出气流的大小受装置中两液面差的影响。
⑤打开活塞时,由X端进入的不稳定气流靠漏斗内液面的升降调整压强大小而被缓冲
2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察。“玉兔”月球车底盘和车轮由铝合金材料制成。看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加。
(1)【知识回放】
金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Ag Pt Au。请你在横线上填写对应金属的元素符号。
(2)【作出猜想】
猜想1.Cr>Fe>Cu;猜想2.Fe>Cu >Cr;猜想3.你的猜想是 ____。
【查阅资料】
① 铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
② 铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
(3)【设计与实验】
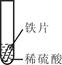
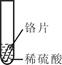
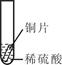
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 |
试管1 |
试管2 |
试管3 |
| 实验 操作 |
 |
 |
 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 |
铬片表面产生气泡较快,溶液变成为蓝色 |
______ |
(4)【结论与解释】
小聪得到的结论是:猜想正确。
(5)【知识运用】
将铬片投入FeSO4溶液中,反应(填“能”或 “不能”)进行。若能进行,请你写出反应的化学方程式 ________________。
如图所示为实验室中常见的气体制备、净化、收集和性质实验的部分仪器。试根据题目要求,回答下列问题: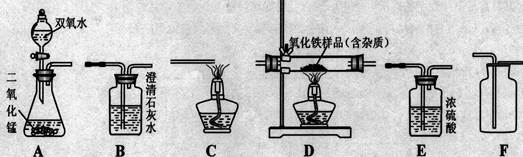
(1) 欲在实验室中制备并收集干燥的氧气。
① 所选仪器的连接顺序为(填写仪器序号字母)。
②仪器A中,发生反应的化学方程式为。
(2) 欲用足量纯净的一氧化碳气体测定某不纯氧化铁样品的纯度 (杂质不反应),并验证反应中气体生成物的性质。所选仪器的连接顺序为:纯净的一氧化碳气体 →D→B→C。
①仪器C的作用是。
②仪器D中发生的化学反应方程式为
③反应完全后,计算氧化铁样品的纯度时,小强同学认为“仪器D中减少的质量等于仪器B中增加的质量”。小丽同学通过称量发现二者质量并不相等。请你分析写出仪器D中减少的是 ________的质量,而仪器B中增加的是 _________的质量。
如图所示,实验室有一瓶标签被部分腐蚀的溶液,已知该溶液不是NaNO3,为确定其成分,某同学进行如下研究。
【初步判断】(1)该溶液不可能是 (填序号).①酸;②碱;③盐.
【实验探究】几位同学设计了如下实验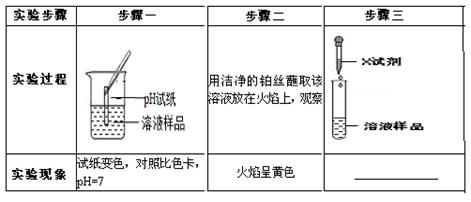
【分析与推理】
(2)“步骤一”存在明显操作错误,该错误是 ;
(3)完成“步骤一”后,可推理出该溶液一定不是溶液(写溶质化学式),你的理由是。
(4)请你设计“步骤三”:
加入的X试剂是,若实验现象是,可推理出该溶液是(写溶质化学式)。
【反思与评价】
(5)上述实验中,步骤(填写序号)是没有必要进行的。
化学实验中常出现意外情况,要根据具体情况区别对待,善于发现和解决问题。例如:
①做细铁丝在氧气中燃烧的实验时,集气瓶底部破裂。可能的一个原因是(27)。
②用下图所示的简易启普发生器制取二氧化碳时,若收集了一定量气体后夹紧b,c内反应物固体与液体无法分开,可能的一个原因是(28)。
③某同学向Na2CO3溶液中滴加BaCl2溶液,发现冒气泡,则BaCl2溶液中可能混有的杂质是(29)
A.盐酸 B.硫酸 C.碳酸钠
④用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊(装置气密性良好)。
【提出假设】假设一:澄清石灰水已变质;
假设二:气体X中除了有CO2外,还有(30)
【实验探究】用下图所示实验探究上述假设是否合理。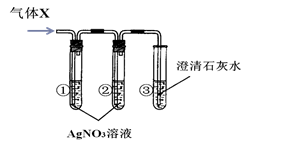
【现象与结论】
| 实验 |
现象 |
分析与结论 |
| 一 |
若:试管①中(31), 试管②中无明显变化, 试管③中液体变浑浊。 |
试管③中发生反应的化学方程式为(32), 结论:假设二成立。 |
| 二 |
若:试管①中出现白色沉淀, 试管②中无明显变化, 试管③中无明显变化。 |
试管②中试剂的作用是(33), 结论:(34)成立 |
探究活动一:在室温条件下进行如图所示实验。已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小均相同;同时加入两支试管中的稀盐酸的质量和质量分数均相等。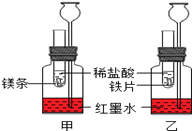
① 该实验的目的是 ⑻、 ⑼。
两支长颈漏斗中产生的现象的不同之处是
⑽。
② 若实验所用的金属均过量,则甲装置中产生的H2比乙装置中产生的H2质量 ⑾(填“多”、“少”或“一样多”)。
探究活动二:为除去铜屑中混有的少量铁屑,并测定该混合物中铁的质量分数,现有如下A、B两组实验方案。
A:称取一定质量的样品,加入足量的稀盐酸,搅拌、过滤、洗涤、干燥、称量所得固体质量。
B:称取一定质量的样品,加入一定量的硫酸铜溶液,搅拌、过滤、洗涤、干燥、称量所得固体质量。
③ 两种方案,你认为不能达到目的是 ⑿(填“A”或“B”),理由是 ⒀。
④ 在你所选取的方案中,若采用加热烘干的方式干燥滤渣,会导致测定的铁的质量分数 ⒁(填“偏大”、“偏小”、“不变”或“无法判断”)。