用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
⑴用硫酸亚铁晶体配制上述FeSO4溶液时还需加入____________。
⑵除去蒸馏水中溶解的O2常采用________的方法。
⑶生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________。
方法二:如右图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
⑷在试管Ⅰ里加入的试剂是____________。
⑸在试管Ⅱ里加入的试剂是____________。
⑹这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________________________。
根据下面的反应路线及所给信息填空。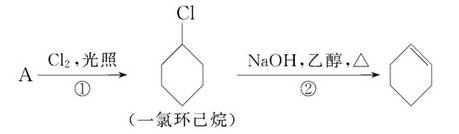
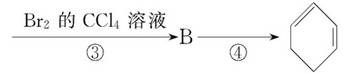
(1)A的结构简式是_______,名称是________。
(2)①的反应类型是________,③的反应类型是________。
(3)反应④的化学方程式是____________。
(1)在A~F中:
| A.11H和21H |
| B.甲烷和己烷 |
| C.金刚石和石墨 |
| D.正丁烷和异丁烷 |
E.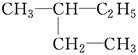 和
和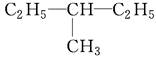
F.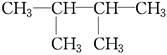 和
和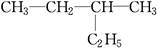
①属于同分异构体的是________,②属于同位素的是________,③属于同素异形体的是________,④属于同一种物质的是________。
(2)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式______,并写出其所有可能的结构简式__________________。
茶叶中含有咖啡因和单宁等多种物质。咖啡因有弱碱性,又叫咖啡碱;单宁有弱酸性,又叫单宁酸。咖啡因既是天然的食品添加剂,又是制药工业的重要原料,从茶叶中提取咖啡因具有重要的意义。咖啡因的溶解性状况如下表。
| 溶剂 |
沸水(100 ℃) |
热水(80 ℃) |
水(25 ℃) |
热乙醇(60 ℃) |
乙醇(25 ℃) |
氯仿(25 ℃) |
乙醚(25 ℃) |
| 溶解度/g |
66.6 |
18.2 |
2 |
4.5 |
2 |
18.2 |
0.19 |
单宁酸能溶于水、乙醇、丙酮和甘油,几乎不溶于乙醚、苯、氯仿和石油醚。
(1)从茶叶中浸取咖啡因,下列溶液中最好的是________(填字母代号),这样选择的理由是________________________________________________________________________
________________________________________________________________________。
A.热乙醇 B.沸水 C.乙醇与乙醚的混合物
(2)用所选择的溶剂浸取的咖啡因溶液里含有的主要杂质是__________。
(3)从澄清的茶叶浸取液中提取不带结晶水的咖啡因或带结晶水的咖啡因,都需要有一个合理的实验方案和操作步骤。请从下列项目中选取,先组成提取不带结晶水的咖啡因的实验操作步骤:______________,再组成提取带结晶水咖啡因的实验操作步骤:______________。(填序号)
①蒸发浓缩 ②焙烧 ③加石灰、蒸干 ④升华 ⑤过滤 ⑥冷却结晶
已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合样品,通过实验进行分离,可得到固体甲(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)。请填写表中空格,完成由上述混合物得到固体甲的实验设计(见下表)。
| 序号 |
实验步骤 |
简述实验操作(不必叙述如何组装实验装置) |
| ① |
溶解 |
将混合物放入烧杯中,加入98%H2SO4,充分搅拌直到固体不再溶解 |
| ② |
||
| ③ |
||
| ④ |
||
| ⑤ |
洗涤沉淀 |
|
| ⑥ |
检验沉淀是否洗净 |
回答下面的问题:
(1)分离沸点不同但又互溶的液体混合物,常用方法是:______________;
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。