茶叶中含有咖啡因和单宁等多种物质。咖啡因有弱碱性,又叫咖啡碱;单宁有弱酸性,又叫单宁酸。咖啡因既是天然的食品添加剂,又是制药工业的重要原料,从茶叶中提取咖啡因具有重要的意义。咖啡因的溶解性状况如下表。
| 溶剂 |
沸水(100 ℃) |
热水(80 ℃) |
水(25 ℃) |
热乙醇(60 ℃) |
乙醇(25 ℃) |
氯仿(25 ℃) |
乙醚(25 ℃) |
| 溶解度/g |
66.6 |
18.2 |
2 |
4.5 |
2 |
18.2 |
0.19 |
单宁酸能溶于水、乙醇、丙酮和甘油,几乎不溶于乙醚、苯、氯仿和石油醚。
(1)从茶叶中浸取咖啡因,下列溶液中最好的是________(填字母代号),这样选择的理由是________________________________________________________________________
________________________________________________________________________。
A.热乙醇 B.沸水 C.乙醇与乙醚的混合物
(2)用所选择的溶剂浸取的咖啡因溶液里含有的主要杂质是__________。
(3)从澄清的茶叶浸取液中提取不带结晶水的咖啡因或带结晶水的咖啡因,都需要有一个合理的实验方案和操作步骤。请从下列项目中选取,先组成提取不带结晶水的咖啡因的实验操作步骤:______________,再组成提取带结晶水咖啡因的实验操作步骤:______________。(填序号)
①蒸发浓缩 ②焙烧 ③加石灰、蒸干 ④升华 ⑤过滤 ⑥冷却结晶
某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢原子。
(1)A的结构简式为;
(2)已知A、B、C有下列转化关系,则反应②的化学方程式为;
C的化学名称为。 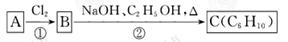
写出下列反应的离子方程式,或相应的化学方程式(每题2分7小题共14分)
(1)石灰石溶于稀盐酸。
(2)稀硫酸与氢氧化钡溶液的反应。
(3)碳酸氢钠溶液与盐酸反应。
(4)氢氧化铜与稀硫酸反应。
(5)2H++ CO32-=CO2↑+H2O 。
(6)Cu+2Ag+=Cu2++2Ag。
(7)CO2+2OH-=CO32-+H2O。
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此回答下列问题:
(1)该硫酸的物质的量浓度为mol/L。
(2)配制250mL 0.92mol·L-1的稀硫酸需取该硫酸mL。
(3)配制时必需的玻璃仪器有:______________________________________________________。
(4)定容时,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是______。
(5)定容时,若加入的水超过刻度线,必须采取的措施是。
(6)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:;
②容量瓶用水洗净后未烘干:;
③定容时俯视容量瓶的刻度线:。
(1)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,_______是氧化剂;_______是还原剂;_______元素被氧化;_______元素被还原;______是氧化产物;_______是还原产物,被还原的HNO3与参加反应的HNO3物质的量之比是_____。用双线桥标出该反应电子转移的方向和数目。
(2)双线桥标出反应KClO3+ 6HCl=KCl + 3 Cl2↑ + 3H2O电子转移的方向和数目。
(1)8 g CH4的物质的量为,在标准状况下所占的体积约为;
(2)100mL 1 mol·L-1Al2(SO4)3溶液中含Al3+离子mol,含SO42-离子个。
(3)0.6mol O2与0.4mol O3质量之比为,分子个数之比为,原子个数之比,它们在同温同压下的体积比是。