1)相同物质的量浓度下的各溶液:NaX、NaY、NaZ,其PH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序为:
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是
(3)把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连,可以组成各种原电池。若a b相连,a为负极;c d相连,c为负极;a c相连,c为正极;b d相连,b为正极,则四种金属的活动性由强到弱顺序为:
(4)写出Na2CO3溶于水后的电离方程式: ________________________________________________________
(5)写出氯化铁溶液水解反应的离子方程式: ______________________________________________
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如下图所示,其中A、B、C都为气体。则该反应的化学方程式为。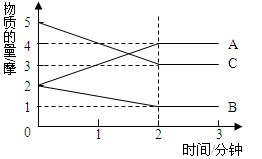
下列递变规律不正确的是
| A.Na.Mg、Al还原性依次减弱 |
| B.I2、Br2、Cl2氧化性依次增强 |
| C.原子半径:F<Mg<K |
| D.稳定性:PH3>H2S> HCl |
氮元素可形成卤化物、叠氮化物及络合物等。
(1)在铜催化作用下F2和过量NH3反应得到NF3,其分子立体构型为_____________;NF3是_________键结合形成的___________分子(填极性或非极性)。固态NF3晶体熔点比冰______________(填高或低)。
(2)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-。
①与N3-互为等电子体的分子有:(举2例),由此可推知N3-的立体构型是型。
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co(N3)(NH3)5]SO4、Fe(CN)64-。写出钴原子在基态时的电子排布式:;[Co(N3)(NH3)5]SO4中钴的配位数为;配位原子结构特征是________;CN-的电子式是。
(3)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是(选填序号)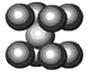
| A.NaN3与KN3结构类似,前者晶格能较小 |
| B.第一电离能(I1):N>P>S |
| C.钠晶胞结构如上图,该晶胞分摊2个钠原子 |
| D.氮气常温下很稳定,是因为氮的电负性大 |
(4)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体可溶于水,该种异构体的结构可用示意图表示为。
(5)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于醚、丙酮等有机溶剂。据此判断三氯化铁晶体类型为____________;
(6)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。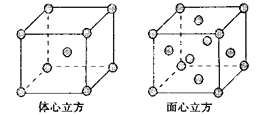
( 9分)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
①某同学根据上述信息,某同学推断B的核外电子排布如图所示,该同学所画的电子排布图违背了________。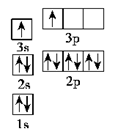
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为____________。A原子杂化类型是_______________。
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C—C的键长为154.45 pm,C60中C—C键长为145~140 pm,有同学据此认识C60的熔点高于金刚石,你认为是否正确__________理由是____________________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为____________。晶胞中每个C60分子周围与之等距离且最近的C60分子数是_________。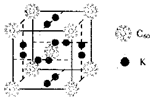
③继C60后,科学家又合成了Si60、N60;C、Si、N原子电负性由大到小的顺序是____________。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为________。
(3)1986年,瑞士两位科学家发现一种性能良好的金属氧化物超导体,使超导工作取得突破性进展,为此两位科学家获得了1987年的Nobel物理学奖。其晶胞结构如图。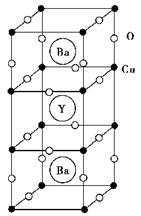
①根据图示晶胞结构,推算晶体中Y、Cu、Ba和O原子个数比,其化学式________。
②已知该化合物中各元素的化合价Y为+3价,Ba为+2价,Cu为+2价和Cu为+3价,根据①所推出的化合物的组成,试计算化合物中这两种价态Cu原子个数比_______________。
③Ba2+的配位数为___________。
(10分)有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D元素与B元素的质量比为7:8;E元素与B元素的质量比为1:1。试回答:
(1)写出D原子的电子排布式____________________。
(2)用电子式表示AE2的形成过程________________________________________。
(3)B、C两元素的第一电离能较大的元素是:________(填写元素符号)。
(4)C的氢化物的VSEPR模型为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为:________>________(填写化学式)。
(6)由元素D组成的单质晶体中,与某个D原子距离最近的D原子有_____个;1molD的氧化物晶体中,含D-O键的数目____________。