当前,一次性筷子、一次性饭盒的安全也受到社会的关注。专家介绍说,正规的一次性筷子所用的原料都是质地较好的木材,不用特殊加工。但是很多小作坊为了降低成本,使用劣质木材,为筷子看上去白一些,他们常用硫磺进行熏蒸漂白,结果造成二氧化硫严重超标,同时硫磺中含铅、汞等重金属,也会对人体造成铅中毒或汞中毒。

(1)“硫磺熏蒸”是应用二氧化硫的漂白性质,写出硫磺燃烧的化学方式
___________________________________________
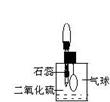
(2)防止、减小毒筷“中毒”最简单的方法是用凉水清洗筷子表面,减少二氧化硫的含量。为研究SO2的溶解性质,某学生做如下实验:如右图,集气瓶中收集的是SO2,瓶塞系着瘪气球,向瓶中滴加紫色石蕊试液,实验现象是________。为比较SO2和CO2溶解性的大小,某学生采取同样的装置和操作,能说明SO2在水中的溶解性大于CO2在水中溶解性的实验现象是____________。某学生取出瓶中溶液,将其滴入品红溶液,充分振荡,实验现象为_______,接着向溶液中加入足量氯水,实验现象为_______,再滴加BaCl2溶液,实验现象为_____________。
(3)在制一次性筷子时有“抛光”程序:加入滑石粉和木签一起搅拌,起到干燥、打磨的作用,使筷子变得光滑,以免毛疵划人的口腔。已知滑石粉是一种含水的具有层状结构的硅酸盐矿物。其质量组成为MgO 31.88%,SiO2 63.37%,H2O 4.75%,其化学式为 。
(4)有的厂家用石蜡代替“滑石粉抛光”,石蜡是含碳原子数(C20~C30)较多的稠环芳香烃,常温下为固体,温度高时熔化后可随食物进入人体致使慢性中毒。有如右的一系列物质,则A的分子式为 ,A、B、C 可以互称同系物吗?为什么?_____________?该系列化合物里碳的最大质量分数为 ? 若E是A的一个氢原子被羟基取代的产物,预测E可能具有哪些化学性质(至少举2条)
|
(1) 、—CH3、
、—CH3、 都是重要的有机反应中间体,有关它们的说法正确的是_________________
都是重要的有机反应中间体,有关它们的说法正确的是_________________
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
D. 中的碳原子采取sp2杂化,所有原子均共面 中的碳原子采取sp2杂化,所有原子均共面 |
E.两个—CH3或一个 和一个
和一个 结合均可得到CH3CH3
结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:第________周期,第________族,属于________区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。葡萄糖分子中碳原子杂化方式有___________;写出基态Zn原子的电子排布式___________________。
生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2等)与 H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有 Cu、Zn、Al 等元素。写出基态 Cu2+离子的核外电子排布式_______________________________________;
(2)根据等电子原理,写出 CO 分子的结构式______________________;
(3)甲醇催化氧化可得到甲醛,甲醛与新制 Cu(OH)2的碱性溶液反应生成 Cu2O 沉淀。
①甲醛分子中碳原子轨道的杂化类型为_____________________;
②甲醛分子的空间构型是__________________;
③ 1 mol 甲醛分子中 σ 键的数目为__________________。
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
(1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有______种,原子中所有电子占有______个轨道,核外共有_________个不同运动状态的电子。
(2)E原子核外占有9个轨道,且具有1个未成对电子,E离子结构示意图是_____________。
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是______,F2-的电子排布式是_______________________________。
(4)M能层上有____个能级,有____个轨道,作为内层最多可容纳______个电子,作为最外层时,最多可含有______个未成对电子。
(5)在元素周期表中,最外层只有1个未成对电子的主族元素原子处于________________族;最外层有2个未成对电子的主族元素原子处于__________________族。
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 经过时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
30 |
120 |
280 |
350 |
370 |
①反应速率最大的(即0~1 min、1~2 min、2~3 min、3~4 min、4~5 min)时间段为 ,原是 。
②反应速率最小的时间段为 ,原因是。