(17分)人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+ O2(g) △H="+765.0kJ" /mol。
O2(g) △H="+765.0kJ" /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。
Ⅱ.目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ /mol。
2NH3(g) △H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
1)请选用适当的试剂和分离装置除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及装置的编号填入表中。
试剂: a.水 b.溴的CCl4溶液 c.溴水 d.NaOH溶液
分离装置:
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 |
| 混合物 |
需加入的试剂 |
分离方法 |
|
| ① |
1一氯丙烷 (乙醇) |
||
| ② |
乙烷 (乙烯) |
||
| ③ |
溴化钠溶液(碘化钠) |
||
| ④ |
苯 (苯酚) |
(2)下列实验能获得成功的是________。
①向溴乙烷中加入NaOH溶液充分反应后,取上层清液并加入AgNO3溶液可观察到有淡黄色沉淀生成。
②向苯酚溶液中加入浓溴水可观察到有白色沉淀生成
③不慎把苯酚溶液沾到了皮肤上,应立即用酒精洗涤。
④用酸性高锰酸钾溶液鉴别苯和甲苯
⑤用酸性高锰酸钾溶液鉴别己烯中是否混有少量甲苯
⑥实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃。
烷烃A(C6H14)结构中共有四个甲基,能生成三种一氯代产物B、C、D。
B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示(反应中生成的无机产物已略去),G分子中含有醛基(-CHO)。

请回答:
(1)写出结构简式:A;C;E。
(2)写出反应类型名称:B→F;F→E。
(3)写出F转化为G的化学方程式_________________
有以下一系列反应,终产物为乙二醛。
已知B的相对分子质量比A的大79,请回答:
(1)写出结构简式:A; E。
(2)写出B转化为C的化学方程式_________________
有机物的结构可用“键线式”简化表示
如:CH3-CH=CH-CH3可简写为 。某有机物X的键线式为
。某有机物X的键线式为 。
。
(1)有机物X的分子式为。
(2)X与足量的H2在一定条件下反应可得到有机物Y,则Y分子的一氯取代产物有种。
(3)X的同分异构体Z属于芳香烃,能使溴水褪色,Z的结构简式为,
该芳香烃Z在一定条件下可发生聚合反应,写出其反应的化学方程式。
(4)某醇W与X的相对分子质量相同,1 mol W与足量Na反应能产生标准状况下的氢气22.4 L,经测定W分子有如下特点:①一个碳原子最多连接一个官能团;②该分子不存在官能团位置异构现象。则W的结构简式为。
下表是A、B二种烃的有关信息;
| A |
B |
①能使含溴的四氯化碳溶液褪色;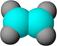 ②比例模型为: ②比例模型为:③能与水在一定条件下反应 |
①由C、H两种元素组成;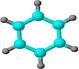 ②球棍模型为: ②球棍模型为: |
根据表中信息回答下列问题:
(1)A与含溴的四氯化碳溶液反应的生成物的名称叫做;
写出在一定条件下,A生成高分子化合物的化学反应方程式_______。
(2) A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=_________时,这类有机物开始出现同分异构体。
(3) B具有的性质是(填序号):
①无色无味液体、②有毒、③不溶于水、④密度比水大、
⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:。