为探究四瓶未知无色溶液的成分,甲、乙、丙三组同学分别设计了如下实验。已知四种溶液分别是Na2CO3、NaOH、Ca(OH)2和稀盐酸中的一种。
【实验过程】
甲组实验方案:将四瓶溶液标号分别为1、2、3、4,只利用紫色石蕊溶液进行实验。
| 实验步骤和操作 |
实验现象和结论 |
||
(1)如图所示: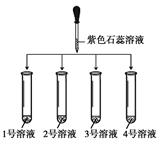 |
① 2号溶液由无色变为红色, 则2号溶液是 ② 另三支试管中溶液均由无色变蓝色 |
||
(2)另取1、3、4号溶液,分别滴加2号溶液
|
① 3号溶液中有气泡放出, 则3号溶液是 ② 另外二支试管中溶液无明显变化 |
||
| (3)另取1、4号溶液,分别滴加 |
①1号溶液中有白色沉淀析出, 则反应的化学方程式为 ② 另一支试管中溶液中无明显变化 |
乙组实验方案:不用其他试剂进行实验。
| 实验操作 |
实验现象 |
实验结论 |
| 任取三种溶液于三支试管中,分别滴加第四种溶液 |
①一支试管中有气泡放出 其余二支试管中溶液无明显变化 |
① 第四种溶液为稀盐酸 |
| ② 一支试管中有白色沉淀析出, 其余二支试管中溶液无明显变化 |
② 第四种为Na2CO3溶液 |
|
| ③ 三支试管中溶液均无明显变化 |
③ 第四种为NaOH溶液 |
【实验分析】
经过交流后,发现实验结论 (填序号)是不正确的;若该结论作正确,对应的实验现象应是 。
丙组实验方案:将四种溶液编号为1、2、3、4,不用其他试剂进行实验。
| 实验操作 |
实验现象 |
实验结论 |
||
如图所示:
|
①A、B、C均无明显变化 ②D中有沉淀析出 |
标号为1、2、3、4的溶液依次为(用化学式表示): 或 |
粗盐中除含泥沙等不溶性杂质外,还含有少量的可溶性杂质(如 、 等),工业上以粗盐为原料制取精盐的生产流程如图所示。

请回答下列问题:
(1)“操作1”的名称是_____。
(2)向滤液F中加入稀盐酸发生中和反应的化学方程式为_______________。
新冠疫情期间,口罩成为人们与病毒隔离的重要屏障。某实验小组为了弄清口罩的构造和关键材料的化学组成,进行了以下实验探究。
Ⅰ.探究口罩的构造
取一个医用口罩,用剪刀将其剪开,观察到里面有银白色的金属条,口罩分三层。查阅资料得知内外层为无纺布,中间层为熔喷布,成分均为聚丙烯。用显微镜观察,中间层最致密,测得孔径小于 。
(1)大部分飞沫直径集中在 。口罩能有效防止病毒通过飞沫传播的原理相当于化学实验中的 _____(填操作名称)。
Ⅱ.探究熔喷布的元素组成
聚丙烯属于有机物,含有碳元素,还可能含有氢、氧元素。实验小组取 熔喷布,设计如图所示装置进行实验(部分夹持装置略去),实验过程中观察到装置B中 形管内固体变为蓝色,C中澄清石灰水变浑浊。

已知:无水 为白色固体,吸水后变成蓝色晶体。
(2)装置B的作用是 __________。
(3)装置C中发生反应的化学方程式是 _______________。
(4)实验时,若装置B和C调换位置,对实验产生的影响是 ____________________。
(5)实验过程中持续通入干燥 ,熔喷布在装置A中完全燃烧,测得装置B质量增加 ,装置C、D质量共增加 。通过计算判断:
①熔喷布中是否含有氧元素?_____(填“含有”或“不含有”)。
②聚丙烯分子中碳原子与氢原子的个数比是 _____。
某校学生用盐酸和碳酸钙制备 ,产生了大量废液。兴趣小组通过以下探究确定废液处理方案。
(1)废液成分的确定
①写出制备 的化学方程式_______。
②推测废液所含溶质
推测一:_______ 推测二: 和
③若要用一种药品验证哪种推测成立,可选择的有哪些?_______(填标号)
| A. |
石蕊溶液 |
B. |
溶液 |
C. |
锌粒 |
D. |
粉末 |
(2)废液的处理
实验表明废液中的溶质是 和 ,小组决定用 除去它们。
【提出问题】如何估算 固体的用量?
【进行实验】取 废液样品于烧杯中,逐滴滴加 的 溶液,用 传感器测定滴加过程中溶液的 。实验结果如图所示。

【结果讨论】
①a→b阶段,观察到烧杯中的现象是_______。
②b点后曲线平缓阶段,反应的化学方程式为_______。
③c点时,取少量烧杯中的清液于试管中,滴加 溶液,有白色沉淀生成,说明处理 废液,所需 的 溶液的体积_______ 。(填“大于”“等于”或“小于”)
④将烧杯中的沉淀过滤、干燥、称重,质量为 。若处理 该废液,理论上需要 固体___ 。(实验所用 溶液的密度近似看做 )
陶瓷是火与土的结晶,是中华民族文化的象征之一
(1)下列中学实验室常见用品中,材质为陶瓷的是 (填标号)。
| A. |
烧杯 |
B. |
集气瓶 |
C. |
蒸发皿 |
D. |
坩埚钳 |
(2)烧制陶瓷的原料为黏土,某黏土的成分如下表,所列出的四种氧化物中属于非金属氧化物的是_______。(写化学式)
|
成分 |
二氧化硅 |
氧化铝 |
氧化铁 |
氧化镁 |
其它 |
|
质量分数/% |
|
|
|
|
|
(3)“九秋风露越窑开,夺得千峰翠色来”描述的是著名的青瓷。
①手工制作陶瓷的过程如下图,陶瓷丰富的色彩与烧制过程中的还原反应有关。燃料(以木炭为例)在窑体内燃烧,通过两步反应生成 ,化学方程式为_______、_______。

②青瓷的“翠色”来源十分复杂。涉及窑体内的 和瓷器表面粙料中的氧化铁在高温下反应生成氧化亚铁,化学方程式为_______。
(4)古代窑炉(如下图)构造不断变迁。为了提高窑体内 的体积分数,下列措施中可行的有哪些? 。(填标号)

| A. |
相对增加燃料用量 |
B. |
相对增加空气鼓入 |
| C. |
增加排气口数量 |
D. |
减少排气口数量 |
天然气的主要成分为甲烷,燃烧可能会产生 ,为了检验天然气燃烧后的气体产物成分,进行如下实验:

(1)实验开始时,点燃 处酒精灯之前,先通一会儿 ,其目的是____________________。
(2) 中无水 变蓝,说明气体产物中含有水; 中澄清石灰水变浑浊,证明气体产物中含有_____(填化学式)。
(3) 装置中发生反应的化学方程式为_______________。
(4)实验中观察到 装置中__________, 装置中__________,说明气体产物中还有 。
(5) 处为尾气处理装置,下列装置中合理的是_____。
