已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的 极相连。阴极上的电极反应式为
电解过程中,硫酸铜的浓度会 (选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 |
反应 |
平衡常数 |
| 1 |
Au + 6HNO3(浓) Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<< 1 |
| 2 |
Au3+ + 4Cl— AuCl4— AuCl4— |
>>1 |
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程: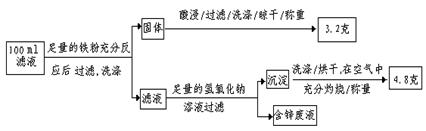
则100mL滤液中Cu2+的浓度为 mol·L-1,Fe2+的浓度为 mol·L-1
(14分) 芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。
反应原理:
反应试剂、产物的物理常数:
| 名称 |
相对分 子质量 |
性状 |
熔点 |
沸点 |
密度 |
溶解度 |
||
| 水 |
乙醇 |
乙醚 |
||||||
| 甲苯 |
92 |
无色液体易燃易挥发 |
-95 |
110.6 |
0.8669 |
不溶 |
易溶 |
易溶 |
| 苯甲酸 |
122 |
白色片状或针状晶体 |
122.4 |
248 |
1.2659 |
微溶 |
易溶 |
易溶 |
主要实验装置和流程如下:
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
(1)无色液体A的结构简式为。操作Ⅱ为。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是。
(3)下列关于仪器的组装或者使用正确的是。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.图1回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入,分液,水层再加入,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为。
碳酸钙、盐酸是中学化学实验中的常用试剂。
(1)甲同学拟测定CaCO3固体与过量0.1 mol·L-1HCl的反应速率。
① 该反应的化学方程式为_________。
② 设计两种实验方案:
方案一:通过测量_________和__________计算反应速率
方案二:通过测量_________和__________计算反应速率
③ 配制250mL 0.1 mol·L-1HCl:量取___________mL 10 mol·L-1HCl加入烧杯中,加适量蒸馏水,搅拌,将溶液转入__________中,洗涤,定容,摇匀。
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响。
限选试剂与用品:0.1 mol·L-1HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
① 设计实验方案:在固体表面积或反应物浓度不同的条件下,测定________(要求所测得的数据能直接体现反应速率大小)。
② 拟定实验表格,完整体现实验方案。(表格列数自定;列出所用试剂的用量、待测物理量和拟定的数据;数据可用字母a、b、c等表示)
| 物理量 实验序号 |
V(0.1mol/L HCl)/mL |
…… |
实验目的:实验1和2探究固体表面积对反应速率的影响;实验1和3探究反应物浓度对反应速率的影响 |
|
| 实验1 |
…… |
|||
| 实验2 |
…… |
|||
| 实验3 |
…… |
乙醛在催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
| 沸点 |
20.8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |
请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置。在实验开始时温度计水银球的位置应在___________,目的是_____________________________;当试管A内的主要反应完成后,应进行蒸馏操作,温度计水银球的位置应在___________________。
(3)烧杯B内盛装的液体可以是____________(写出一种即可)。
(4)若想检验试管C中是否含有产物乙酸,在下列所提供的药品或用品中,可以使用的是____________。(填字母)
a.pH试纸b.碳酸氢钠粉末
c.红色石蕊试纸d.银氨溶液
亚硝酸钠(NaNO2)是一种外观与食盐相似的食品添加剂。兴趣小组用如下装置制NaNO2 (夹持和加热装置已省略)。已知:2NO+Na2O2 = 2NaNO2;2NO2+Na2O2 = 2NaNO3。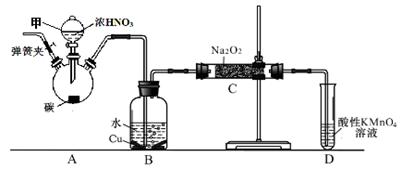
(1)仪器甲的名称是____;
装置A烧瓶中发生反应的化学方程式为。
(2)B装置的作用是。
写出所发生主要反应的化学方程式①;
②。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是(填字母)。
A.浓H2SO4B.碱石灰C.无水CaCl2
(4)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为____ _________。
(12分)为除去粗盐中的Ca2+、Mg2++、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):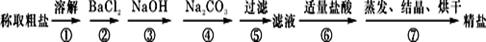
(1)步聚⑤步实验操作需要的玻璃仪器有烧杯、_____ ____、__ ___。
(2)步聚④步中,相关的离子方程式是、。
(3)步聚②中,判断加入BaCl2已过量的方法是:。
(4)除杂试剂Na2CO3、NaOH、BaCl2加入的先后顺序还可以是(用化学式填写,只填一种情况 )
→ →
(5)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是(请写出其中一个离子方程式) 。