实验为测定一新配制的稀盐酸的准确浓度,通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取w g无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,为准确起见,滴定终点宜选择在pH 4~5之间,则在中学学过的几种指示剂应选_______________,当滴定溶液由_____色变成_____色时,即表示达滴定终点.
(2)若滴到终点时,中和w g Na2CO3消耗盐酸V mL,则盐酸的物质的量浓度为________mol·L—1。
(3)若所称取的Na2CO3不纯,测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1mol·L-1,用不纯的Na2CO3标定测得盐酸为c2mol·L-1,在下述情况下,c1,c2的关系是 (空填>、<或=)
①当Na2CO3中含有NaHCO3时,cl_____c2;
②当Na2CO3中含有NaOH时,cl_____c2;
③当Na2CO3中含有Na2CO3·10H2O时,cl_____c2。
(10 分)游泳池水的含氯气量应该控制在0.5mg/L至1.0 mg /L之间,
(1)写出氯气溶于水后的化学方程式。
(2)你认为哪几天的天气炎热、阳光强烈,理由是。(用化学方程式表示)
(3)小型泳池通常使用次氯酸钠溶液而非氯气来消毒池水,试举出使用次氯酸钠溶液而非氯气的一项理由。用化学方程式说明工业上如何生产次氯酸钠溶液。
(8分)将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。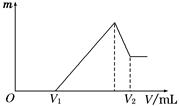
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中镁粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1 mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
(8分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_______________________________。
(2)流程乙加入烧碱后生成SiO 的离子方程式为___________________________。
的离子方程式为___________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入__________________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_____(填化学式),写出该溶质的一种用途________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
(10分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是( )
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用下图表达。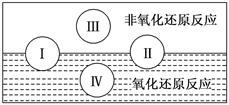
试写出有参水加的符合反应类型Ⅳ的一个化学方程式:
________________________________________________________,其中水为________剂。
(3)氯化铵常用作焊接。如在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:____CuO+____NH4Cl ____Cu+____CuCl2+____N2↑+____H2O。
____Cu+____CuCl2+____N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是____________(填化学式)。
③反应中若产生0.2 mol的气体,则有________ 个电子转移。
(12分) (1)含氯消毒剂可防甲型H1N1流感。二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得。请写出反应的离子方程式___________________________________________。
(2)某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cl-、OH-、HCO 、NO
、NO 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
①该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有____,一定不会含有大量的________。
②该溶液与Al2O3反应后有AlO 生成,则原溶液中一定含有________,可能含有大量的________。
生成,则原溶液中一定含有________,可能含有大量的________。
③写出该溶液与Al2O3反应生成AlO 的离子方程式__________________________________。
的离子方程式__________________________________。