常温下,对下列四种溶液的叙述正确的是( )
| 编号 |
① |
② |
③ |
④ |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A、②、③两溶液相比,溶液中水的电离程度不同
B、四种溶液分别加水稀释10倍,pH变化最大的是①和③
C、①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D、①、④两溶液按一定体积比混合,所得溶液中离子浓度的关系不存在:c(H+)>c(Cl-)>c(OH-)>c(NH4+)
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH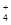 )> c(SO )> c(SO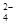 )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO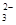 )+c(HCO )+c(HCO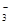 )+c(OH-) )+c(OH-) |
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO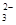 ) ) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c (Na+)>c(H+)> c (OH-) |
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
| A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-) |
| B.HN3与NH3作用生成的叠氮酸铵中全都是共价键 |
| C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-) >c(OH-)>c(H+) |
| D.N3-与CO2含相等电子数 |
汽车剧烈碰撞时,安全气囊中发生反应: 。则下列判断错误的是
。则下列判断错误的是
| A.该反应能在瞬间完成,并产生大量气体 |
| B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol |
| C.该反应中的氧化剂为KNO3 |
| D.被氧化和被还原的N原子的物质的量之比为15:1 |
下列图示与对应的叙述不相符的是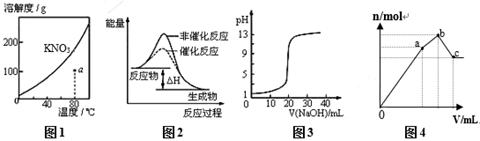
| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| C.图3表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到滴定曲线 |
| D.图4 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
元素周期律揭示了元素间的递变规律,下列递变规律正确的是
| A.第二周期元素氢化物稳定性:HF>H2O, 所以第三周期元素氢化物稳定性:HCl>H2S |
| B.ⅣA族元素氢化物沸点:SiH4 > CH4,所以ⅤA族元素氢化物沸点:PH3 > NH3 |
| C.ⅦA族元素的非金属性:F>Cl, 所以ⅦA族元素氢化物的酸性:HF>HCl |
| D.镁比铝活泼,工业上用电解熔融氧化铝,所以工业上也是电解熔融氧化镁制镁 |