利用下图装置采用适当试剂可完成实验某探究实验,并得出相应实验结论,实验所用试剂或所得结论列于表中。请回答: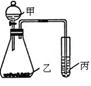
| 实验试剂 |
实验结论 |
||
| 甲 |
乙 |
丙 |
|
| ① |
高锰酸钾 |
② |
氧化性:KMnO4>Cl2>Br2 |
 (1)图中①为 ,②为 。
(1)图中①为 ,②为 。 (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;
(2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;
| 试剂甲 |
试剂乙 |
试剂丙 |
丙中现象 |
实验结论 |
| |
|
|
|
酸性:盐酸>碳酸 |
| |
|
石蕊试液 |
|
|
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。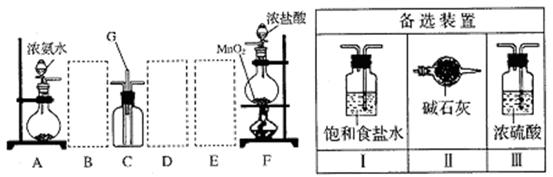
请回答下列问题:
(1)装置F中发生反应的离子方程式是。
(2)装置A中的烧瓶内固体可选用(选填以下选项的代号)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格。B、D、E。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:。
(5)若从装置C的G处逸出的尾气中含有N2和少量C12,应如何处理?
。
某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此实验小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。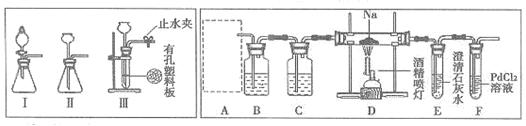 已知:常温下,CO能使一些化合物中的金属离子被还原。
已知:常温下,CO能使一些化合物中的金属离子被还原。
例如:PdCl2+CO+H2O=Pd↓+CO2+2HCl
反应生成黑色的金属钯,此反应也可用来检测微量CO的存在。
请回答下列问题:
(1)通常实验室制取CO2气体的离子方程式是,为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是(填写“Ⅰ”、“Ⅱ”或“Ⅲ”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是溶液,装置C中应盛放的试剂是。
(2)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:
①若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
②若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是。
某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:
①加入过量盐酸,有气体生成;
②在上面所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
③在②所得溶液中再加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
(1)则原溶液中一定不能大量存在的离子是,可能存在的离子是。
(2)实验①中发生反应的离子方程式为,。
(3)实验②中气体成分是,沉淀甲的成分是。
(4)实验③中气体成分是,沉淀乙的成分是。
下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为(填代号)。能验证CO氧化产物的现象是。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应,活塞b应。E中反应的化学方程式为。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加 NaOH 固体,E内装有铂铑合金网,按A→G→E→D装置程序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有:。
②实验中观察到E内有红棕色气体现出,证明氨气具有性。
硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
| 项目 |
指标 |
||
| 优等品 |
一等品 |
合格品 |
|
| 外观 |
白色结晶,无可见机械杂质 |
无可见机械杂质 |
|
| 氮(N)含量 |
≥21.0﹪ |
≥21.0﹪ |
≥20.5﹪ |
新华中学化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观]该硫酸铵化肥无可见机械杂质。
[实验探究]按右图所示装置进行实验。
(1)①盛放浓氢氧化钠溶液的仪器名称是
②烧瓶内发生反应的离子方程式为:
________________
③烧杯中最适宜盛放的试剂是__________
| A.浓硫酸 | B.稀硫酸 |
| C.盐酸 | D.氨水 |
④B装置中为何不将导管直接插入试剂中
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原 因是
因是
_____________________________
[交流讨论]甲同学:根据此实验测得的数据,计算硫酸铵化肥的氮含量可能偏高,因为实验装置A和B间存在一个明显缺陷是:______________ __________乙同学:根据甲同学改进后计算硫酸铵化肥的氮含量又可能偏低,因为实验装置中还存在另一个明显缺陷是:____________________________
__________乙同学:根据甲同学改进后计算硫酸铵化肥的氮含量又可能偏低,因为实验装置中还存在另一个明显缺陷是:____________________________
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论] 称取13.5g硫酸铵化肥样品,用改进 后的实验装置重新进行实验,测得实验前后B装置增重3.40g。该化肥_________
后的实验装置重新进行实验,测得实验前后B装置增重3.40g。该化肥_________ (填“是”或“不是”)一等品。
(填“是”或“不是”)一等品。