下图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择,a、b为活塞)。
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为 (填代号)。能验证CO氧化产物的现象是 。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A→E→D→B→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应 ,活塞b应 。E中反应的化学方程式为 。
(3)若气体入口改通空气,分液漏斗内改加浓氨水,圆底烧瓶内改加 NaOH 固体,E内装有铂铑合金网,按A→G→E→D装置程序制取干燥氨气,并验证氨的某些性质。
①装置A中能产生氨气的原因有: 。
②实验中观察到E内有红棕色气体现出,证明氨气具有 性。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行了有关实验: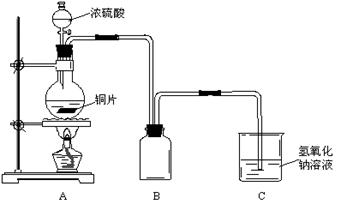
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写字母编号)。
A.铁粉 B.氯化钡溶液C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,某位同学进行了如下设计:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中可行的是__________(填写字母编号)。其中计算结果余酸物质的量浓度比实际偏高的是_______________(填写字母编号)
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀(已知:硝酸具有强氧化性)
若A项不可行,请写出改进的方法:___________________(若A项可行则该空写“不用改进”)
Ⅰ已知:Na2S2O3 + H2SO4 = Na2SO4 + SO2↑ + S↓ + H2O某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
| 实验序号 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
| V/mL |
c/(mol/L) |
V/mL |
c/(mol/L) |
V/mL |
||
| ① |
20 |
10.0 |
0.10 |
10.0 |
0.50 |
0 |
| ② |
40 |
V1 |
0.10 |
V2 |
0.50 |
V3 |
| ③ |
20 |
V4 |
0.10 |
4.0 |
0.50 |
V5 |
(1)该实验①、②可探究对反应速率的影响,因此V1=,V2=;V3=;
(2)实验①、③可探究对反应速率的影响,因此V4=,V5=;
(3)下列有关该的相关叙述正确的是
A.实验前,应先在一张白纸上用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间
B.该实验所需的计量仪器有量筒、温度计
C.实验时,应先将量取的Na2S2O3 和H2SO4溶液混合,然后置于相应温度的热水浴中反应,记录每组反应所需时间
D.每组实验至少需要两支量筒
(4)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小?。
Ⅱ利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可以定量测定市售硫代硫酸钠(Mr=158)的纯度,现在称取Wg硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用含有I2为amol/L的碘水滴定,消耗碘水bmL,则:
(1)验过程中滴定管应该选择的是(酸式或碱式)滴定管,滴定前可以选择做指示剂,滴定终点的现象为
(2)对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,应对滴定管、锥形瓶进行润洗操作
B.滴定过程中,标准液滴到锥形瓶外,会使所测结果偏大
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,则所测得的纯度将会偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
(3)样品中硫代硫酸钠纯度的表达式为。
(14分)某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 ,直到加入一滴盐酸,溶液的颜色由色变为,且半分钟不褪色,即停止滴定。
(2)下列操作中使所测氢氧化钠溶液的浓度数值偏低的是 (填序号)。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为mL,
终点读数为mL。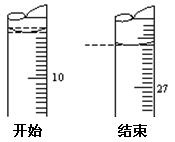
(4)如已知用C(HCl)=0.1mol/L的盐酸测定20 mL的氢氧化钠溶液测得C(NaOH)=mol/L。
草酸晶体的组成可表示为H2C2O4·xH2O。为测定草酸晶体中草酸的质量分数,进行下列实验。
①称取m g草酸晶体,配成100.0 mL溶液。
②用移液管取25.0mL所配草酸溶液放入于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4溶液滴定。滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4 K2SO4+10CO2↑+2MnSO4+8H2O
K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验②中,除移液管、锥形瓶、烧杯、铁架台外,还需要的实验仪器主要有:、。
(2)本实验滴定过程中操作滴定管的图示正确的是_________(填编号)。
(3)判断达到滴定终点的现象是。
(4)若滴定时,滴定前后两次读数分别为a mL和b mL,由此计算出草酸晶体中草酸的质量分数为_____。若读取读数a时仰视,读取读数b时俯视,则所测得草酸的质量分数____(选填“偏大”、“偏小”或“不变”)。
科学探究结果的准确性有赖于探究方法的科学性。某课外活动小组用下图装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
请回答下列问题:
(1)装置F中发生反应的化学方程式为_____________;浓盐酸在该反应中所表现出的性质为_____________、_____________。
(2)装置E的作用是:__________________________。
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式__________________________。
(4)该活动小组中甲、乙两位同学按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:__________________________,其有关反应的离子方程式为__________________________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?_______________________。