科学探究结果的准确性有赖于探究方法的科学性。某课外活动小组用下图装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
请回答下列问题:
(1)装置F中发生反应的化学方程式为_____________;浓盐酸在该反应中所表现出的性质为_____________、_____________。
(2)装置E的作用是:__________________________。
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式__________________________。
(4)该活动小组中甲、乙两位同学按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:__________________________,其有关反应的离子方程式为__________________________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?_______________________。
某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出假设】
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
【设计实验方案.验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 |
实验操作 |
实验现象 |
结论 |
| 方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
| 方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是。
(2)乙同学认为方案2得到的结论正确,白色物质为。
(3)通过方案1和方案2的实验,你认为上述三个假设中,成立。你的理由是。
(4)钠在二氧化碳中燃烧的化学方程式为。
(5)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:。
学习卤代烃性质时,我们知道溴乙烷在不同溶剂中与氢氧化钠发生不同类型的反应,生成不同的反应产物。我们可以通过实验的方法去验证反应的产物:
(1)在溴乙烷与氢氧化钠的乙醇溶液的(反应类型)中可以观察到有气体生成。某同学用如下图所示装置对该气体进行验证,他所观察到的现象是;
(2)盛水试管的作用是;
(3)除了用酸性高锰酸钾溶液外,还可以用试剂检验该气体,其反应原理是(用化学方程式表示)。
(4)另一位同学取少量溴乙烷与氢氧化钠水溶液反应后的混合溶液,向其中滴加硝酸银溶液,加热,产生少量沉淀。该同学由此得出溴乙烷与氢氧化钠水溶液反应,生成了溴化钠。老师和同学都认为这样不合理。若请你用实验验证该反应中生成了溴化钠,你与该同学实验方案不同的实验方法是。
已知SO2、SiO2、CO2等氧化物化学物质具有一定的相似性。用下图所示装置进行Mg与SO2反应的实验。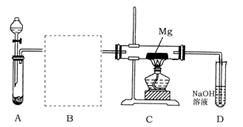
(1)选择制取SO2的合适试剂(填编号);
①20%的HNO3溶液②80%的H2SO4溶液③Na2SO3固体④CaSO3固体
(2)在方框中画出B的装置图并注明试剂;
(3)实验后对C装置玻璃管中的固体成分进行分析,未检测到单质硫,则Mg与SO2反应的产物除MgO外另一种是(填化学式),请用实验加以证明。
研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的步骤如下:
①向装置图所示的U形管和大烧杯中加入冷水;②在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;③向装置图所示的圆底烧瓶中加入一定量研细的溴化钠和少量碎瓷片;④将冷却至室温的混合液转移到圆底烧瓶中,加热;⑥制取溴乙烷。同答下列问题: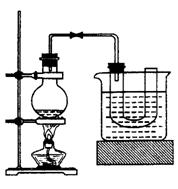
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:
(2)步骤④加热片刻后,烧瓶内的混合物出现橘红色,出现这种现象的原因是(请用化学反应方程式表示)改用小火加热后,橘红色会逐渐消失,消失的原因是(请用化学反应方程式表示)
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是
。
(4)步骤⑤反应结束后,将U形管中的混合物用方法得到粗产品。除去粗产品中的杂质,可用下列试剂中的____,
| A.氢氧化钠稀溶液 | B.碳酸钠稀溶液 |
| C.硝酸银溶液 | D.四氯化碳 |
探究二:溴乙烷与NaOH乙醇溶液的反应。学习小组在进行溴乙烷与NaOH乙醇溶液的反应中,观察到有气体生成。
请你设计两种不同的方法分别检验该气体。
| 所用试剂操作方法 |
实验现象 |
|
| 1 |
||
| 2 |
Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO。
提出假设:
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
(1)假设3:
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是。
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?。
简述你的理由。
(4)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是,写出发生反应的离子方程式、、。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(5) 实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为。