课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题: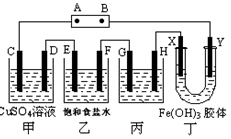
(1)电源A 极的名称是___________
(2)甲装置中电解反应的总化学方程式是____________________________
(3)如果收集乙装置中产生的气体,两种气体的体积比是__________。
(4)欲用丙装置给铜镀银,G应该是___(填“铜”或“银”),电镀液的主要成分是 (填化学式)。
(5)装置丁中的现象是
氮化铝(AlN)是一种新型的无机非金属材料,工业上由氧化铝与焦炭在氮气流中高温制得。请回答下列有关问题。
(1)氮化铝 (AlN)制备:Al2O3+N2+3C
(AlN)制备:Al2O3+N2+3C 2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为。
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为。
(2)AlN产品中常含有Al4C3、碳和Al2O3等杂质,已知Al4C3与水反应生成CH4,CH4与CuO发生反应:
CH4+4CuO CO2+2H2O+4Cu。为测定产品中有关成分的含量,所需仪器如下:
CO2+2H2O+4Cu。为测定产品中有关成分的含量,所需仪器如下: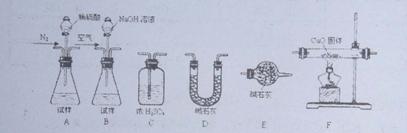
【测定样品中Al4C3的含量】
若各装置连接的顺序为:A→C→F→C→D→E,请补充操作步骤:
①称量D的质量,按顺序组装仪器,检查装置的气密性,将试样放入锥形瓶中;
②;③;④;⑤;⑥再次称量D的质量;
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变。
【测定AlN的含量】
已知AlN能够水解,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
→→→E。若试样为mg ,测得C增重n g,则AlN的质量分数是。
某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图。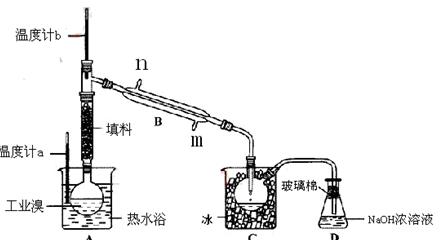
请你参与分 析讨论:
析讨论:
①图中仪器B的名称: ,冷却水从进,出;
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 ;
⑤烧杯A的作用, D中液体的作用是。
(1)点燃不纯的氢气可能会发生爆炸,为了防止意外,可连接一个安全装置。下图的装置能起到此作用的是___________。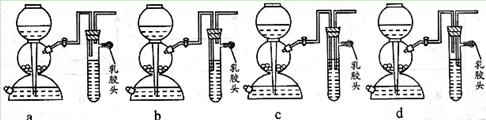
(2)取一定量的饱和氯水与CaCO3粉末混合,观察到少量气泡,氯水的黄绿色褪去,静止后取上层澄清溶液四份,分别进行以下实验:
① 一份滴加盐酸,产生大量气 泡
泡
② 一份滴加NaOH溶液,出现白色沉淀
③ 一份用酒精灯加热出现白色沉淀
④ 将有色布条浸入第四份溶液,布条立即褪色
由上述实验现象推测该澄清溶液的主要溶质是;
实验①可以用方程式表示;
饱和氯水与CaCO3粉末发生反应的化学方程式。
已知HI是一种无色,有刺激性气味,极易溶于水的气体,HI的水溶液称之为氢碘酸,是一种强酸。
(1)请写出I元素在周期表的位置:第五周期 族
(2)将 HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能有气体。
HI气体通入一定量的浓硫酸中,产生的混合气体除含HI、少量的I2蒸气和水蒸气外,还可能有气体。
(3) 小明拟对HI通入浓硫酸后的混合气体成分进行验证和探究。他设计了如下实验装置图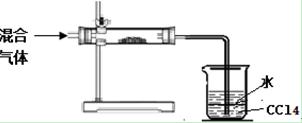
初步探究设计:
①其中直形玻璃管中所装的药品是(写名称)
②足量四氯化碳的两个作用是: 。
进一步探究:
查阅资料:氧化性强弱KMnO4>HNO3>I2>SO42-,且较稀的硝酸不能氧化I2。
③小明拟对溶在水层的其它混合气体成分做进一步探究。请你从以下限选试剂中选择合适的试剂帮小明完成实验报告。
限选的试剂:石蕊试剂、品红溶液、酸性KMnO4溶液、0.1mol/L HNO3、淀粉溶液、BaCl2溶液
| 实验方案 |
可能的现象和相应的结论 |
| 取少量烧杯中的上层溶液分装入A、B两支试管中 |
|
用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验。(实验装置如右图所示)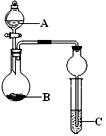
(1)若B中是生石灰,C中盛有AlCl3溶液,将A中液体逐滴加入B内,实验
中观察到C溶液中出现白色沉淀。则A中液体的是 (填名称)
C中发生反应的离子方程式为 。
(2)若要制O2,B为黑色固体,A中的试剂是(填化学式),C中盛
有FeCl2和KSCN的混合液,旋开分液漏斗的开关后,发现C中溶液变为
血红色,写出C 中发生氧化还原反应的离子方程式 。
(3)已知氧化性强弱:KMnO4>Cl2>KIO3>I2。若A中装有浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,C中的现象是 ,继续反应一段时间后,发现C中溶液的颜色褪去,这是因为