氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
SiO2+ C+ N2 Si3N4+ CO
Si3N4+ CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是 。
(3)分析反应可推测碳、氮气的氧化性:C N2(填“>”“<”“=”)。
(4)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是 。
| A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
| B.在电子工业上制成耐高温的电的良导体 |
| C.研发氮化硅的全陶发动机替代同类型金属发动机 |
| D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
(12分)工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3、SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下: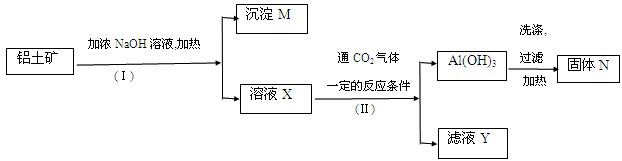
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是。
(2)沉淀M中除含有泥沙外,一定还含有,固体N是。
(3)滤液X中,含铝元素的溶质的化学式为,它属于(选填“酸”、“碱” 或“盐”)类物质。
(4)实验室里常往AlCl3溶液中加入(选填“氨水”或NaOH溶液)来制取Al(OH)3
(12分)A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如下所示转化关系。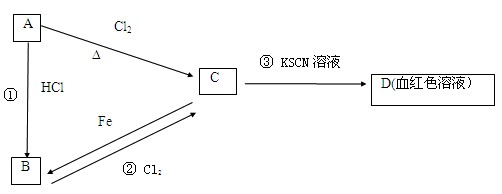
试回答下列问题:
(1)A是,C是。
(2)C的溶液与NaOH溶液混合后的现象是。
(3)反应①的反应类型是反应(选填“化合”“分解”“置换”“复分解”)。
与50ml 0.1mol/LNa2CO3溶液中Na+的物质的量浓度相同的是(填代号)。
①25ml 0.2mol/L的NaCl溶液②100ml 0.1mol/L的NaCl溶液
③25ml 0.2mol/L的Na2SO4溶液④10ml 0.5mol/L Na2CO3溶液
某同学在试管Ⅰ和试管Ⅱ中分别加入3ml稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。将气球内的0.3gNaHCO3和0.3gNa2CO3同时倒入试管中。请回答下列问题:
①试管Ⅰ和试管Ⅱ发生反应的离子方程式分别为。
②加入固体后,试管(填“Ⅰ”或“Ⅱ”)上的气球膨胀较快。
(10分)如下图,A、B、C、D、E各代表铁、水、三氧化硫盐酸和氢氧化钡中的一种物质。在常温下,相连环物质之间能发生反应,不相连环物质之间不能发生反应。且B的相对分子质量小于D。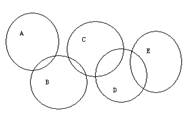
(1)五种物质中属于氧化物的有(填化学式)。
(2)请写出氢氧化钡的电离方程式。
(3)请写出铁与水蒸气在高温下发生反应的化学方程式。
(4)请写出下列物质的化学式:B,D。