(1)常温下,0.05mol/L硫酸溶液中,c(H+)= mol/L,pH值为 ,水电离的c(H+)= mol/L。如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。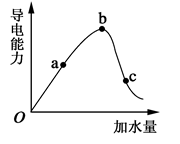
(2)“O”点为什么不导电 。
(3)a、b、c三点的氢离子浓度由小到大的顺序为 。
(4)a、b、c三点中,醋酸的电离程度最大的一点是 。
(5)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择 。
A.加NaCl溶液 B.加热
C.加固体KOH D.加Zn粒
E.加固体CH3COONa F.加水
(6)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.H+个数 B.c(H+)
C.c(H+)/c(CH3COOH) D.CH3COOH分子数
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、c三种溶液,电极均为石墨电极。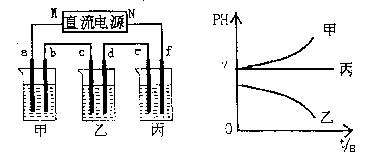
接通电源,经过一端时 间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的:极(填写“正”或“负”) ,甲、乙电解质分别为、(填写化学式)。
,甲、乙电解质分别为、(填写化学式)。
(2)写出d电极上发生反应的电极反应式.
(3)若电解后甲溶液的体积为 25L,且产生的气体全部逸出则该溶液常温时的pH为。
25L,且产生的气体全部逸出则该溶液常温时的pH为。
(4)若丙装置产生的两种气体与氢氧化钠溶液、铂电极形成燃料电池,请写出正极的电极反应式:.
(5)要使电解后丙中溶液恢复到原来的状态,应加入物质。(填写化学式)
有机物A~F存在如下转化关系,A的化合物的水溶液呈弱酸性 ,A、C分子中含C、H两元素的质量分数和均为85.19%,相对分子质量均为108。F含两个环且有一个对位甲基。
,A、C分子中含C、H两元素的质量分数和均为85.19%,相对分子质量均为108。F含两个环且有一个对位甲基。
请回答下列问题:
(1)写出化合物A的分子式____________,B的结构简式________________。
(2)与C具有相同环的同分异构体共有____________ _(含C)种,请写出其中两种不同类别有机物的结构简式(除C外)__________________、_____________________。
_(含C)种,请写出其中两种不同类别有机物的结构简式(除C外)__________________、_____________________。
(3)A中处于同一平面上的原子最多有_________个。
(4)写出F的结构简式____________________。
(5)写出反应④的化学方程式_________________________________
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A原子核内无中子;A和E、D和F分别同主族,且B与D最外层电子数之比为2:3。试回答下列问题:
(1)E元素在周期表中的位置是;
(2)已知101KPa时,A单质的燃烧热为285.8kJ/m01,请写出A单质完全燃烧生成液态水时的 热化学方程式:;
热化学方程式:;
(3)E单质在足量D单质中燃烧生成的化合物的电子式是;
(4)化合物X、Y均由A、D、E、F四种元素组成。
①X、Y均属于化合物(填“离子”或“共价”):
②X与Y的水溶液相混合发生反应的离子方程式为;
(5)化合物E2F的水溶液中滴入双氧水和稀硫酸,加热,有单质生成。其离子反应方程式为:。
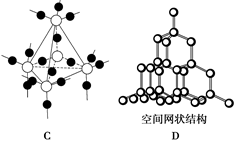
(8分) (1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型 :
:
A.________;B.________;C.________;D.________。
(2)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.________;B.__________;C.________;D.__________。
A、B、C、D四种元素处于同一周期。在同族元素中,A的气态氢化物沸点最高,B的最高价氧化物对应水化物的酸性在同周期中最强,C的电负性介于A、B之间,D与B相邻。(1)C 原子的价电子排布式为___________________
原子的价电子排布式为___________________
(2)A、B、C三种原子的第一电离能由大到小的顺序是(写元素符号)_____。
(3)B的单质分子中存在①个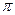 键;D的最简单气态氢化物分子中的中心原子轨道采用②杂化。B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于③_______晶体,其硬度比金刚石
键;D的最简单气态氢化物分子中的中心原子轨道采用②杂化。B和D形成一种超硬、耐磨、耐高温的化合物,该化合物属于③_______晶体,其硬度比金刚石
④(填“大”或“小”)。
(4)A的气态氢化物的沸点在同族中最高的原因________ ____________________。
____________________。