小军家的下水管道堵了。爸爸买回一种“管道通”,使用后堵塞的管道畅通无阻了。小军对此很好奇,于是想探究“管道通”中的物质成分。
【提出问题】“管道通”中的物质是什么?
【查阅资料】主要内容如下。
(1)下水管里的淤积物主要为油污、食物残渣、毛发等。
(2)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西。常用于疏通管道。
(3)铝粉为银灰色固体。铝与酸、碱溶液都能反应放出氢气,反应时放出大量热。
①铝与盐酸反应的化学方程式是 。
②铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH + ==2NaAlO2 +3H2↑
【猜想与验证】小军打开一盒“管道通”,内有一袋白色固体颗粒和一袋银灰色粉末。
(1)猜想:白色固体颗粒为氢氧化钠。
| 实验操作 |
实验现象 |
| ①将几粒白色固体颗粒放在表面皿上,放置一会儿。 |
。 |
| ②将几粒白色固体颗粒放入盛有少量水的试管中,并用手触摸试管外壁。 |
。 |
| ③向步骤②得到的溶液中放入一段羊毛线,加热一段时间。 |
羊毛线逐渐消失。 |
结论:白色固体颗粒为氢氧化钠。
(2)猜想:银灰色粉末为铝粉。
| 实验操作 |
实验现象 |
①按照下图安装两套仪器。 |
|
| ②两套仪器中分别依次加入银灰色粉末和稀盐酸;银灰色粉末和 。 |
都产生大量无色气体,试管外壁温度明显升高。 |
| ③待导管口有气泡均匀持续冒出时,收集1试管气体,验纯。(两套仪器操作相同) |
验纯时的操作和现象:(两套仪器相同) 。 |
| ④在导管口点燃气体。(两套仪器操作相同) |
都产生淡蓝色火焰。 |
结论:银灰色粉末为铝粉。
【应用】使用管道通时,先将其中银灰色粉状固体添加于被堵塞的管道中,然后再加入白色固体颗粒,倒入一杯水,堵上管道口。一会儿,管道内发生化学反应。根据题目信息,推测管道内的反应现象是 。
【反思】①老师告诉小军,氢氧化钾和氢氧化钠的性质非常相似。要确认猜想(1)是否正确,还需要学习如何检验钠元素的存在。
②根据本实验分析,使用“管道通”时,应注意的事项有(填一条即可) 。
小明同学利用已有的知识弄清家里化肥的成分,他看到袋中化肥是白色晶体,用少量肥料跟熟石灰一起研磨,有浓烈的刺激性气味,初步判定是一种氮肥。
为进一步证实肥料的成分,小明将少量肥料样品带到学校进行探究。
| 探究内容 |
现象 |
结论 |
| 实验1:取一定量的肥料放入水中,震荡 |
样品完全溶解 |
_________________ |
| 实验2:取实验1中的部分溶液,滴加石蕊试剂 |
溶液呈红色 |
__________________ |
| 实验3:另取实验1中的部分溶液,滴加氯化钡试剂和稀盐酸 |
有白色沉淀生成 |
该化肥为_________ |
①小明家的化肥是一种铵盐,有同学认为盐的水溶液都呈中性,你同意他的观点吗?请举例说明。____________________________________________________。
②结合探究过程回答,施用该化肥时应注意________________________________。
草酸的化学式为H2C2O4,甲、乙两同学对草酸受热分解及其产物的检验做了探究:
【猜想与假设】
第一种:草酸分解产物是CO2和H2;第二种:草酸分解产物是CO2、CO和H2O ;
第三种:草酸分解产物是 CO2和H2O ;第四种:草酸分解产物是CO2、CO 。
以上猜想,第种一定不可能,原因是。
【查阅资料】无水硫酸铜遇水由白色变成蓝色,碱石灰是一种常用的干燥剂。
【实验设计】(图中铁架台略去)甲同学设计了甲装置,乙同学设计了乙装置。
【实验过程】甲同学按甲装置实验,在给草酸晶体加热时,先,然后固定在底部加热,过一会儿观察到澄清石灰水变浑浊;乙同学按乙装置实验,观察到无水硫酸铜由白色变成蓝色,澄清的石灰水变浑浊,且生成的气体通过碱石灰后,在干燥管的尖嘴处点火能燃烧,乙同学进一步通过实验验证燃烧的气体为CO,他的操作是
,现象是。
【实验结论】第种猜想是正确的。
【反思与评价】乙同学认为甲同学设计的实验装置有缺陷。由于试管口向下倾斜,而且草酸晶体熔点较低,加热到182℃便开始熔化,因此实验中常会出现熔融的草酸流进导管而影响后续实验。甲同学认为乙同学的设计是科学合理的。请你谈谈乙装置优于甲装置之处。(答出一点即可)
化学小组的同学对碳燃烧产生兴趣。
提出问题:将3克碳与8克氧气放入密闭容器中燃烧,产物只有二氧化碳吗?
猜想与假设:燃烧后气体一定含有CO2,可能含有。
查阅资料:向氯化钯(PdCl2) 溶液中通入CO,发生下列反应。请完成化学方程式的书写PdCl2+CO+H2O==Pd↓黑色+CO2+2。
设计实验:小刚设计了下图所示装置。 结合图示回答问题: 实验步骤:
实验步骤:
(1)打开弹簧夹a,关闭弹簧夹b、c 。点燃酒精灯,加热碳粉,A装置中观察到的现象是。
(2)过一会儿,打开弹簧夹b,推动注射器的活塞。
(3)打开弹簧夹c,用注射器向装置中缓缓注入氮气,观察到B中澄清石灰水变浑浊,反应的化学方程式为。小组同学通过实验确定有一氧化碳生成,他们依据的现象是。
实验结论:综合上述实验,并进行理论推导,得出结论。3g碳在8g氧气中燃烧后的混合物中含有。
实验反思:在整个实验过程中,注射器的作用有。
近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
【提出问题】如何通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 H2SO4”。
(2)“二氧化硫和二氧化碳一样,能和澄清石灰石发生反应生成难溶于水的亚硫酸钙(CaSO3),也能使澄清石灰水变浑浊。”请写出二氧化硫使澄清石灰水变浑浊的化学方程式:______________________。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】
(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验: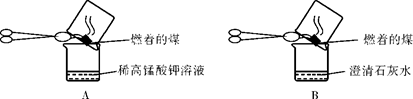
“实验现象”: A,B。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是:。
(5)丙同学:进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是。
(7)丙同学的实验中若已证明煤中含有碳元素和硫元素的现象是:丙同学应看到的实验现象是。
磷(包括红磷和白磷)是初中化学实验中经常使用的物质,化学小组的同学以“磷的燃烧”为主题设计并整理了以下三组实验,请你参与完成:
(1)探究空气中氧气的含量:
实验Ⅰ和Ⅱ装置中,能完成测定空气中氧气体积分数的是(填序号)。红磷燃烧的化学反应方程式为。
(2)探究物质燃烧的条件:
①通过实验Ⅰ得到:可燃物燃烧的必备条件是;
②改进后的装置Ⅱ中可看到的现象是。
③将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如装置Ⅲ所示),结果观察到了“水火相容”的奇观,则大试管所装气体可能是;
(3)利用如右图所示装置探究化学反应过程中物质总质量的变化:实验过程气球的作用是。