近几年我国某些城市酸雨污染较为严重,主要是因为大量燃烧含硫量高的煤而形成的。
【提出问题】如何通过实验证明煤中含有碳元素和硫元素。
【查阅资料】
(1)“二氧化硫能使高锰酸钾溶液褪色(由紫红色变为无色),该反应的化学方程式为:5SO2 + 2KMnO4 + 2H2O = K2SO4 + 2MnSO4 + 2 H2SO4”。
(2)“二氧化硫和二氧化碳一样,能和澄清石灰石发生反应生成难溶于水的亚硫酸钙(CaSO3),也能使澄清石灰水变浑浊。”请写出二氧化硫使澄清石灰水变浑浊的化学方程式:______________________。
根据上述资料,甲同学、乙同学和丙同学分别设计实验方案进行探究。
【实验探究】
(3)甲同学:
“实验操作”:甲同学进行了如下图所示A、B两步实验: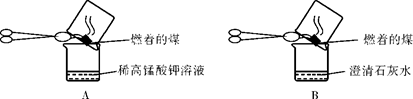
“实验现象”: A ,B 。
“得出结论”:煤燃烧生成二氧化硫和二氧化碳,证明煤中含有碳元素和硫元素。
(4)乙同学认为甲同学的实验方案不合理,其理由是: 。
(5)丙同学:进行了如下图所示实验(部分装置在图中略去):
【探究与结论】(6)上图C装置的作用是 。
(7)丙同学的实验中若已证明煤中含有碳元素和硫元素的现象是:丙同学应看到的实验现象是 。
学习碳酸钠知识时,老师做碳酸钠溶液和澄清石灰水反应演示实验,并对浑浊液过滤,得到澄清滤液。课堂上老师的提问和同学们的回答如图所示。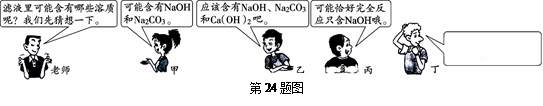
(1)请写出碳酸钠溶液和澄清石灰水反应的化学方程式是。
(2)假设你是丁同学,请你提出一个与甲、乙、丙同学不同的猜想,你的猜想是。
(3)某同学认为乙同学的猜想不合理的,请帮他说明理由。
(4)甲同学针对自己的猜想进行了如下实验:
| 实验步骤 |
实验现象 |
实验结论 |
| 取样于试管中,滴入几滴稀盐酸 |
没有气泡产生 |
猜想不成立 |
你认为甲同学的实验设计是否正确?其理由是。
(5)请你设计实验,证明自己的猜想。
| 实验步骤 |
实验现象 |
实验结论 |
(6)若滤液含有Na+、OH—和CO32—的混合溶液,某同学加适量的CaCl2除去CO32—制得NaOH溶液。该方法是否正确?其理由是。
.某同学在家中发现有两瓶消毒药, 瓶外贴的信息如下:
| 化学名:高锰酸钾 别名:灰锰氧,过锰酸钾,PP粉 化学式:KMnO4 相对分子质量:158.03 性质:是一种常见的强氧化剂,常温下为紫黑色片状晶体,见光易分解 用途:在工业上用作消毒剂、漂白剂等;医学上,用0.01%-0.02%的高锰酸钾溶液消毒、洗胃。 |
化学名:过氧化氢 俗名:双氧水 化学式:H2O2 相对分子质量:34 性质:无色有刺激性气味的液体,不稳定 用途:医疗上常用3%的双氧水进行伤口或中耳炎消毒。 |
依据所给信息,你认为KMnO4和H2O2的保存条件是;
他联系所学的化学知识,做了以下探究,请你跟他共同完成。
(1)实验室制取氧气的知识回顾
| 药品 |
KMnO4 |
H2O2 溶液(MnO2) |
| 反应原理(写方程式) |
||
| 发生和收集装置(选填下图) |

(2)制取氧气的再探究
该同学想既然两种都是消毒药,能否混合使用呢?于是他进行了如下探究:
混合后观察现象:有使带火星的木条复燃的气体产生,混合液由紫红色变为无色,能使酚酞试液变红,有黑色固体产生。
①根据反应现象,该同学尝试书写了将KMnO4加入到H2O2中的化学反应方程式,
请帮他补充完整: 2 KMnO4+3 H2O2 =" 2" MnO2↓+3 O2↑+2 H2O +;
② 该同学觉得制氧气的药品已经齐备,他又收集了家中的以下物品:
a.蜡烛,b.口服液玻璃瓶,c.吸管,d.注射器,e.小塑料瓶。
通过查阅资料得到以下信息:蜡烛火焰温度最高可达540 oC左右;高锰酸钾受热分解温度为240oC左右;口服液玻璃瓶耐高温(800oC)。
若选用KMnO4做反应物制氧气,则发生装置应选用上述物品中的(选填字母);
若选用H2O2和MnO2制氧气,则发生装置应选用上述物品中(选填字母);
燃烧法是一种常用于确定有机物元素组成的实验方法。请完成以下问题:
【定性实验】
(1)甲烷的化学式是
(2)请写出通过甲烷燃烧确定其组成元素的实验方法:
【定量实验】
某有机食品保鲜袋除含有碳元素和氢元素外,可能含有氧元素。为确定该保鲜袋是否含有氧元素,进行如下实验探究。 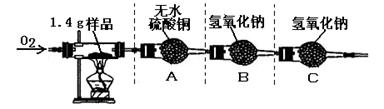
实验过程
①按图示连接好仪器并检验该装置气密性
②称取1.4 g该保鲜袋样品,剪碎后放在硬质玻璃试管中。
③用天平称得装置A的质量为82.0 g;装置B的质量为85.0 g
④持续通入纯O2,点燃酒精灯,直至保鲜袋样品完全燃烧
⑤实验结束,待冷却后,再次用天平称得装置A的质量为83.8g, 装置B的质量为89.4g
请回答
(1)查得资料:白色的无水硫酸铜易吸水,吸水后呈蓝色。根据实验后装置A中固体变蓝的现象说明该保鲜袋含有元素。
(2)根据质量守恒定律,装置B在反应后增加的质量等于1.4 g样品完全燃烧后生成的_____(填化学式)的质量。
(3)通过计算可得,样品中碳元素的质量为;氢元素的质量为。
(4)结论:该保鲜袋样品(填“含有”或“不含有”)氧元素。
(5)若无装置C,则实验测得样品中碳元素的质量会(填“偏大”“偏小”或“无影响”)
(7分)某实验小组的同学在加热铜与浓硫酸的混合物实验时,发现生成了一种无
色有刺激性气味的气体和蓝色溶液,进行如下探究活动.
[查阅资料]①某些不活泼的金属(如铜)能与一些强氧化性的酸(如浓硫酸)发生反应,生成
而不生成氢气,同时生成二氧化硫和铜盐.②硫酸铜溶于水后,溶液呈酸性.
[知识回顾]铜、银_______(能、不能)与稀硫酸、盐酸反应产生氢气.
[分析讨论]⑴对于生成的蓝色溶液,小东认为可能是Cu(NO3)2溶液,小楠认为不可能
Cu(NO3)2溶液,而可能是硫酸铜溶液,小楠的理由是.
⑵写出铜与浓硫酸共热的化学方程式.
⑶小东根据化学方程式说,该方法适用于以铜为原料大量制取硫酸铜,小田认为不适宜,你能说出小田的一个理由吗.
[提出问题]上述蓝色溶液中有无硫酸剩余?
[实验论证]小坤认为可向蓝色溶液中滴加氯化钡溶液,观察有无沉淀产生,经大家讨论后
该方案被否定,你觉得否定该方案的理由是.
[反思评价]⑴有同学提问:为什么不可以用石蕊试液来进行检验?你的回答是.
⑵同学们发现:将足量的铜和足量的浓硫酸置于容器中加热,一段时间后,反应会逐渐变慢,最后反应停止,你能说出反应停止的原因吗? .
(5分)某研究性学习小组为探究镁与水的反应,设计如下实验:
步骤1:将镁条用砂纸打磨至光亮,分成两等份.
步骤2:将一份光亮的镁条置于冷水中,几乎没有观察到任何现象.
步骤3:将另一份光亮的镁条置于热水中,观察到有均匀的气泡产生.
(1)将镁条用砂纸打磨至光亮的目的是.
(2)步骤2中没有观察到任何现象,不能说明镁条与冷水不反应,请举出学习过的一个实例
说明:.
经查阅资料:活泼金属与水反应生成对应的碱和氢气,如果金属活动性越强,生成的碱就越强.某同学就向步骤2的烧杯中滴加酚酞试液,观察到镁条的表面有明显的红色出现,但是红色较淡.该反应的化学方程式为由于Mg(OH)2难溶于水,因此形成的溶液碱性较弱.
(3)步骤2和3对比可知,影响镁与水的反应速率的一个条件是,
为检验生成的气体是氢气,可以采用的方法.