(4分)下列有关实验操作或判断不正确的是______。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大 |
| B.用干燥的pH试纸测定氯水的pH |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.实验室制取NO气体时,既可用排水法收集又可用排空气法收集 |
E.在天平左右两盘中各放一张白纸后,即可将NaOH固体放在白纸上称量
F.观察钾元素焰色反应的操作:先将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于酒精灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察
G.制备氢氧化亚铁时,将盛有NaOH溶液的滴管,伸入硫酸亚铁溶液中
铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题:
(1)放电时:正极的电极反应式是__________________________;电解液中H2SO4的浓度将变____________;当外电路通过1 mol电子时,理论上负极板的质量增加______________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成____________、在B电极上生成____________,此时铅蓄电池的正负极的极性将_________。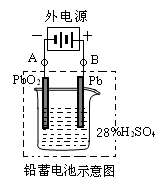
某温度(t ℃)时,水的离子积为KW =1×10-13,则该温度____ 25 ℃(选填“>”“<”“=”),其理由是________________________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比。
(1)若所得混合溶液为中性,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____。(用c(Na+)等表示)
(2)若所得混合液的pH=2,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____。(用c(Na+)等表示)
在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:
H2(g)+I2(g) 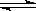 2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
(1)升高温度;
(2)加入催化剂;
(3)充入更多的H2 ;
(4)扩大容器的体积;
(5)保持容器容积不变,通入氖气。
发射卫星用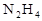 作燃料,
作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: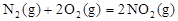 △H1=+67.7kJ/mol
△H1=+67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g)△H2=-534kJ/mol
试写出N2H4与 NO2反应的热化学方程式。
化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:kJ/mol)
| 键能 |
键能 |
键能 |
|||
| H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
| S=S |
255 |
H-S |
339 |
C-F |
427 |
| C-Cl |
330 |
C-I |
218 |
H-F |
565 |
| C-O |
347 |
H-O |
464 |
Si—Si |
176 |
| Si—O |
460 |
O=O |
497 |
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性(填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________< C-Br键能 <__________
(2)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。
(3)已知H2O(l)=H2O(g) ΔH=+44kJ/mol,请写出表示氢气燃烧热的热化学方程式: