(1)小方用右图所示装置对二氧化碳的灭火实验进行研究,观察到的现象是______,实验的结论是_______。
(2)【提出问题】二氧化碳能否支持燃烧?
【猜想假设】镁能在二氧化碳中燃烧。
【查阅资料】①氧化镁、氢氧化镁均是白色难溶于水的固体。
②MgO+2HCl= MgCl2+H2O 、
③MgCl2+2NaOH=Mg(OH)2↓+2NaCl 。
【实验探究】
①右图中镁带剧烈燃烧,冒白烟,有黑色固体生成,并放出大量的热。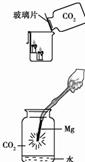
②为检验生成物的成分,做如下实验。
| 实验步骤 |
实验现象 |
实验结论和化学方程式 |
|
| 向广口瓶中加入过量盐酸,充分反应后过滤,在滤纸上留有黑色固体。 |
I、将黑色固体收集、洗涤、干燥后,点燃,在火焰上方罩一个蘸有澄清石灰水的烧杯。 |
黑色固体燃烧,烧杯内壁出现白色浑浊。 |
黑色固体是______;反应的化学方程式是______。 |
| II、取少量滤液于试管中,逐滴加入氢氧化钠溶液。 |
开始_______,后有白色沉淀产生。 |
白烟的成分是______。 |
③为了回收II中的白色沉淀,证明沉淀完全的实验方法是______(要求写出步骤、试剂、现象和结论)。
【反思提高】实验室中由某些活泼金属引起的着火,不能用二氧化碳灭火,应用细沙灭火。
镁铝合金强度大、密度小,合金表面易上色,常用作笔记本电脑的外壳。
Ⅰ.(1)形状大小相同的铝和镁,分别放入同样的盐酸溶液中,下列说法不正确的是(填序号)。
A.两者都发生反应 B.镁比铝反应剧烈 C.铝不与盐酸溶液反应
(2)镁与氢氧化钠溶液不反应,而金属铝能与氢氧化钠、水共同作用生成易溶于水的钠盐(用化学式
表示)和
,写出该反应的化学方程式:。
Ⅱ.三位同学通过进行如下途径探究,来推算某铝镁合金(假设不含其它杂质)中铝的质量分数。
方案一:镁铝合金与氧气反应,测定参与反应的氧气体积。如右图所示,称量一定量镁铝合金粉末,在足量的氧气中充分燃烧,冷却至室温,打开止水夹。参与反应的氧气体积与相等。
方案二:铝镁合金与盐酸反应,测定生成气体的体积。装置如右图所示。
(1)通过排水法测定所收集到的氢气体积,装
置导管口
的连接顺序是:
a→
(2)反应结束,冷却至室温。烧瓶内还留有气体,对实验结果(填"有"或"没有")影响。

方案三:铝镁合金与氢氧化钠溶液反应,测定剩余固体质量。称取
镁铝合金样品,把
氢氧化钠溶液平均分成三份依次加入样品中,反应过程如下图:
(1)实验中所加的氢氧化钠溶液应过量,其目的是。
(2)从上图数据可知,该合金中镁元素与铝元素的质量比为。
【反思与拓展】利用铝镁合金中铝与氢氧化钠溶液反应反应和方案二装置,通过测定
体积,也可得出合金中铝的质量。
请结合下列装置图回答问题:
Ⅰ.(1)仪器 的名称是;(2)写出一种可使用 装置收集的气体.
Ⅱ.(1)实验室常用
在二氧化锰催化作用下制取
,选用的发生装置是(填序号).
(2)写出
在二氧化锰作用下分解的化学方程式:.
(3)
和
都可作为
分解的催化剂.下图2是探究
和
对
分解催化效果的实验,可通过观察(填现象),判断两者的催化效果.
Ⅲ.(1)写出实验室制取 的化学方程式:.
(2)要验证
不支持燃烧、密度比空气大的性质,你认为用下图3的(填"甲"或"乙")实验操作方法效果更好(夹持装置已略).
小强在实验室里做实验时,拿出一瓶久置的氢氧化钙粉末,进行如下实验:
(1)取氢氧化钙粉末溶于足量水中,有_______________现象出现,小强判断该药品已变质。
(2)小强进一步做如下实验探究,请你参与并完成下表:
| 实验操作步骤 |
实验现象 |
实验结论 |
|
| 取样、加适量的水,搅拌,过滤。 |
①取少量滤渣于试管中,加入_____ |
有气泡产生 |
粉末变质 |
| ②取少量滤液于试管中,滴入______溶液。 |
________________ |
氢氧化钙粉末部分变质。 |
(1)下图是实验室制备物质、探究物质性质的常用装置,请回答:
①仪器a、b的名称分别是;
②连接装置A、E可用来制取氧气,装置A应与E的端连接,反应的化学方程式为
;
③除去CO中少量的CO2,最好将气体通过装置,理由是;
④连接装置B、C可用来验证CO的还原性,CO通过装置B时可以看到;装置C中出现白色浑浊,那么,装置B中发生反应的化学方程式。
(2)课外学习小组为进一步探究活泼金属与酸反应的情况,做了以下两组对比实验(见下图)。
请分析实验Ⅰ、Ⅱ后回答:①实验Ⅰ反映了同种金属跟不同酸反应的剧烈程度不同;实验Ⅱ则表明了剧烈程度不同,原因是;
②按照实验Ⅰ和Ⅱ设计思路,请你再设计一组对比实验,简述实验方案。
某研究性学习小组在实验中发现:不仅碱溶液可以使酚酞试液变红,Na2CO3溶液也能使酚酞试液变红。碱溶液可以使酚酞试液变红,是因为碱在水中解离出了OH-,那么Na2CO3溶液中究竟是哪种粒子可以使酚酞试液变红呢?他们设计了如图三个实验,请你和他们一起探究并完成下列问题:
(1)实验Ⅰ是为了;
(2)实验Ⅱ加入蒸馏水的目的是,小组内有同学认为实验Ⅱ没必要做,你认为他们的理由是;
(3)实验Ⅲ滴入K2CO3溶液,振荡,酚酞试液变红,向变红后的溶液中再逐滴滴入过量的CaCl2溶液,红色逐渐消失,同时还观察到生成。由实验Ⅰ、Ⅱ、Ⅲ得出结论:CO32-可以使酚酞试液变红;
(4)小组同学在与老师交流上述结论时,老师说:“其实Na2CO3溶液能使酚酞试液变红也是由于溶液中存在OH-”。你认为Na2CO3溶液中存在OH-的原因是。