甲、乙、丙、丁4位同学对氯化镁样品(仅含氯化钠杂质)进行如下检测:各取5.0 g样品溶于一定量的水中得到25.0g溶液,再分别加入不同质量、溶质质量分数为10%的氢氧化钠溶液,反应后得到沉淀及有关实验数据如下表:
| 4位同学的实验 |
甲 |
乙 |
丙 |
丁 |
| 加入氢氧化钠溶液质量 (g) |
29.0 |
34.5 |
40.0 |
45.0 |
| 反应得到沉淀的质量 (g) |
2.1 |
2.5 |
2.9 |
2.9 |
反应的化学方程式为:MgCl2+2NaOH→Mg(OH)2↓+2NaCl,试回答下列问题:
(1)恰好完全反应的是_______同学的实验。
(2)计算样品中所含氯化镁的质量分数(写出计算过程,结果精确到0.1%,下同)。
(3)计算丙同学实验后所得溶液中的氯化钠的质量分数。
为测定某矿石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
| 实验 |
1 |
2 |
3 |
4 |
| 加入样品质量/g |
5 |
10 |
15 |
20 |
| 生成CO2质量/g |
1.76 |
3.52 |
4.4 |
m |
(1)上表中m的数值是_________。
(2)试计算这种石灰石中碳酸钙的质量分数。
实验室一瓶新购进的浓硫酸,其标签的部分内容如图所示。
| 化学纯 500mL 浓硫酸(H2SO4) 含H2SO4 98% 密度密度 1.84g/mL |
(1)若该瓶硫酸还没有开封使用,瓶内溶液的质量为 g。
(2)若要配制9.8%的稀硫酸400g,则需用该浓硫酸 mL(计算结果保留至0.1)。
(3)配制稀硫酸的过程中,除了用到量筒、胶头滴管、烧杯外,还需要用到的仪器可能有 。
(4)若量取浓硫酸时采用仰视的方法,则配制的溶液溶质质量分数 9.8%(填“>”、“=”或“<”)。若取该9.8%的稀硫酸100g与足量的镁充分反应后,所得溶液的质量为 g。
用溶质质量分数为15%的氯化钠溶液来配制500g溶质质量分数为6%的氯化钠溶液,需要15%的氯化钠溶液的质量多少克?
硝铵是一种常见的化肥,化学式为 NH4NO3。试计算:
(1)求硝铵中各元素的质量比;
(2)求硝铵中氮元素的质量分数;
(3)硝铵的市场价格为810元/1000kg,某人用405元购买此化肥,问:相当于购买到了多少kg氮元素?
NH3常用来制取常见的氮肥。下图是两种化肥包装袋上的部分说明: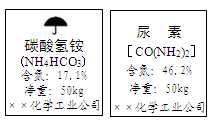
(1) NH4HCO3中N的质量分数是 。
(2) 碳酸氢铵化肥中NH4HCO3的质量分数是 。
(3) 两袋碳酸氢铵化肥与多少千克尿素化肥中的氮元素质量相等?(结果均保留一位小数)