下列各溶液中,微粒的物质的量浓度关系正确的是
A.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:
c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液.(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是()
A.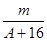 (A-n+8)mol (A-n+8)mol |
B.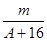 (A-n+10)mol (A-n+10)mol |
| C.(A-n+2)mol | D.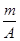 (A-n+6)mol (A-n+6)mol |
同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是HXO4>H2YO4>H3ZO4,则下列判断错误的是 ( )
| A.原子半径X>Y>Z | B.气态氢化物的稳定性HX>H2Y>ZH3 |
| C.非金属性X>Y>Z | D.阴离子的还原性Z3->Y2->X- |
aXn-和bYm+两种简单离子,其电子层结构相同,下列关系式或化学式正确()
| A.a – n =" b" + m | B.a + m =" b" + n |
| C.氧化物为YOm | D.氢化物为HnX或XHn |
原子的种类决定于原子的
| A.原子量大小 | B.核内质子数和中子数 | C.最外层电子数 | D.核电荷 |
下列关于金属元素特征的叙述正确的是( )
| A.金属元素的原子只有还原性,离子只有氧化性 |
| B.金属元素在化合物中一定显正价 |
| C.金属元素在不同化合物中化合价均不同 |
| D.所有的金属单质在常温下均是固体 |