相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g) 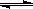 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a < b < 92.4 B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③ D.N2的转化率:② > ① > ③
胶体区别于其他分散系的本质特征是()
| A.胶体的分散质能通过滤纸孔隙,而悬浊液的分散质不能通过滤纸孔隙 |
| B.胶体产生丁达尔效应 |
| C.分散质粒子直径在1nm~100nm之间 |
| D.胶体在一定条件下能稳定存在 |
用可溶性钡盐检验S O42-离子的存在时,先在待测溶液中加入盐酸,其作用是()
O42-离子的存在时,先在待测溶液中加入盐酸,其作用是()
A.形成较多的白色沉淀 |
B.形成的沉淀纯度更高 |
| C.排除SO42-以外的其它阴离子及Ag+的干扰 | D.排除Ba2+以外的其它阳离子的干扰 |
三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。选择一种试剂把它们区别开,该试剂是()
| A.盐酸 | B.氢氧化钠溶液 | C.氯化钡溶液 | D.硝酸 |
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是()
| A.分液漏斗 | B.普通漏斗 | C.蒸馏烧瓶 | D.容量瓶 |
欲萃取碘水中的I2,不能作为萃取剂的是()
| A.苯 | B.酒精 | C.CCl4 | D.汽油 |