有一瓶无色混和气体,是由HCl、O2、NH3、NO、CO2、N2中的某些气体组成。①把混和气体通过浓硫酸后,气体体积明显减小;② 剩余气体通过碱石灰后,气体体积又明显减小;③ 最后,剩余气体接触空气时,立即变为红棕色。由此可见,原混和气体中,一定含有________________,一定不含__________________(提示: NH3可与H2SO4反应而被吸收,而干燥时与CO2不反应)。
(9分)在温度T1和T2下,X2(g)和 H2反应生成HX的平衡常数如下表:
| 化学方程式 |
K (T1 ) |
K (T2) |
F2+H2 2HF 2HF |
1.8 × 1036 1036 |
1.9 ×1032 |
Cl2+H2  2HCl 2HCl |
9.7 ×1012 |
4.2 ×1011 |
Br2+H2  2HBr 2HBr |
5.6 ×107 |
9.3 ×106 |
I2+H2  2HI 2HI |
43 |
34 |
(1)仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_______(选填字母)
a. 在相同条件下,X2的平衡转化率逐渐降低 b. X2与H2反应的剧烈程度逐渐减弱
c. HX的稳定性逐渐减弱 d. HX的还原性逐渐
(2)在容积为3L的密闭容器中,由I2(g)和H2(g)合成HI(g),在其他条件不变的情况下,研究温度对反应的影响,HI的物质的量的变化情况如下图所示。
①温度为T1时,在0~tAmin内,H2的消耗速率v (H2)=__________
②分析右图所示图像,下列说法正确的是________(填序号)
a.温度为T2,容器内气体密度不变时,反应到达B点所示状 态
态
b.平衡状态从A点移动到B点,n(HI)/n(H2)增大
c.该反应为放热反应
(3)加水稀释0.1mol·L-1的HF溶液,下列各量中增大的是________(填序号)
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
(4)在0.1mol·L-1HCl溶液中加入过量AgNO3溶液,产生白色沉淀,再滴加KI溶液,出现黄色沉淀,试写出有关的离子方程式、。
(15分)能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式为__________________________________________。
(2)已知:C(s)+O2(g)===CO2(g);ΔH=-437.3 kJ·mol-1
H2(g)+O2(g)===H2O(g);ΔH=-285.8 kJ·mol-1
CO(g)+O2(g)===CO2(g);ΔH=-283.0 kJ·mol-1
则煤气化反应C(s)+H2O(g)===CO(g)+H2(g)的焓变ΔH=________kJ·mol-1。
(3)如下图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200 mL。
①甲装置中气体A为(填“CH4”或“O2和CO2”),d极上的电极反应式为_____________。
②乙装置中a极上的电极反应式为____________________________。
若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4________ mL (标准状况),乙装置中所得溶液的pH=__________。(忽略电解前后溶液体积变化)
③如果乙中电极不变,将溶液换成饱和Na2SO4溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为________(用含w、a的表达式表示,不必化简)。
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系:(无机物略去)



请完成下列各题:
(1)A物质的结构简式为:________________。
(2)J中所含的含氧官能团的名称为__________________________________。
(3)E与H反应的化学方程式是__________________________;
反应类型是__________。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是_______________。
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式。
①与FeCl3溶液作用显紫色;②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。______________________________________
A、B、C、D、E、F、G七种物质中,其中A、D、E为单质,且D、E为气态,G为液态,它们之间存在如下转化关系: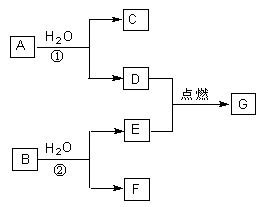
(1)当A、B的质量相等时,生成的D和E恰好完全反应,则C的电子式是;反应②的离子方程式是。
(2)当A、B的质量比为38:21时,生成的D和E的物质的量之比为1:2,且恰好完全反应,则B的电子式为;反应①的化学方程式是。
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)  2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H > 0已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志。
| A.消耗1molN2同时生成1molO2 | B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 | D.2V(N2)正=V(NO)逆 |
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是(填字母序号)。
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是