A、B、C、D、E、F、G七种物质中,其中A、D、E为单质,且D、E为气态,G为液态,它们之间存在如下转化关系: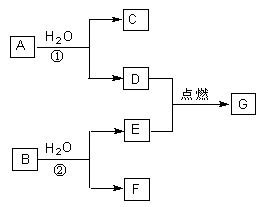
(1)当A、B的质量相等时,生成的D和E恰好完全反应,则C的电子式是 ;反应②的离子方程式是 。
(2)当A、B的质量比为38:21时,生成的D和E的物质的量之比为1:2,且恰好完全反应,则B的电子式为 ;反应①的化学方程式是 。
在盛有AgNO3、HBr、Na2CO3、CaCl2、NaI五种无色溶液的试剂瓶上,分别贴有①~⑤的编号。将它们两两混合,产生的现象如下表所列:
| ① |
② |
③ |
④ |
⑤ |
|
| ① |
—— |
↑无色 |
↓白色 |
↓白色 |
无明显现象 |
| ② |
↑无色 |
—— |
无明显现象 |
↓淡黄色 |
无明显现象 |
| ③ |
↓白色 |
无明显现象 |
—— |
↓白色 |
无明显现象 |
| ④ |
↓白色 |
↓淡黄色 |
↓白色 |
—— |
↓黄色 |
| ⑤ |
无明显现象 |
无明显现象 |
无明显现象 |
↓黄色 |
—— |
| 结论 |
请在该表的“结论”中填写这些编号所代表的化学式
欲用实验方法证明KClO3中含有氯元素,可先取适量KClO3及少量于试管中,充分加热后,再溶于适量蒸馏水并过滤,最后取滤液少许,滴加溶液和,有白色沉淀生成,则说明KClO3中含Cl元素.写出有关反应的化学方程式:.
香豆素是一种用途广泛的香料,它可以利用乙醇和B通过以下途径合成,其中B的分子式为C7H6O2。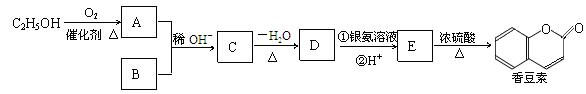
已知: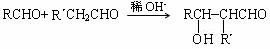 (R、R´为烃基)
(R、R´为烃基)
(1) A的名称为: ,C→D的反应类型为: ,C含有的官能团名称为: 。
(2)D的结构简式是 ;
(3)完成下列反应的化学方程式:
E在一定条件下发生加成聚合反应: ;
E→香豆素: ;
(4)B有多种同分异构体,其中苯环上只有一个侧链的所有同分异构体的结构简式是 ; (5)有关香豆素的说法正确的是 (填字母)。
a.只能与溴单质发生加成反应,不能发生取代反应
b.1 mol香豆素可与5 mol H2发生加成反应
c.1 mol香豆素可与2 mol NaOH发生反应
d.1 mol香豆素完全燃烧消耗9.5mol O2
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是。
(2)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为。
(3)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式。
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式
。
(4)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6mol结晶水。对化合物B进行如下实验:
a 取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b 另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
① B的化学式为。
②已知1 mol·L—1 100mL B的溶液能与1 mol·L—1 20mL KMnO4溶液(硫酸酸化)恰好完全反应。写出反应的离子方程式。
硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下。
(1)以N2和H2为原料合成氨气。反应N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
①下列措施可以提高H2的转化率是(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,气体的总物质的量是原来的 ,则N2的转化率a1=;
,则N2的转化率a1=;
若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸。
①NH3被氧气催化氧化生成NO的反应的化学方程式是。
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g):△H>0
2NO2(g):△H>0
该反应的反应速率(v)随时间(t)变化的关系如右图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态;
b.在t2时,采取的措施可以是升高温度;
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态;
d.在t5时,容器内NO2的体积分数是整个过程中的最大值。(3)硝酸厂常用如下2种方法处理尾气。
①催化还原法:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g):△H=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g):△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是。
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2。
若每9.2gNO2和Na2CO3溶液反应时转移电子数为0.1mol,则反应 的离子方程式是。
的离子方程式是。