工业食盐含Ca2+、Mg2+、SO42-等杂质,要想精炼成精盐,请回答下列问题:
(1)精炼过程所发生的离子方程式为
①_______________________________;
②_______________________________;
③_______________________________。
(2)除去SO42-,必须添加钡试剂,该钡试剂可以是___________
A. Ba(OH)2 B. Ba(NO3)2 C. BaCl2
(3)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为___________.
A. 先加NaOH,后加Na2CO3,再加Ba2+试剂
B. 先加NaOH,后加Ba2+试剂,再加Na2CO3
C. 先加Ba2+试剂,后加NaOH,再加Na2CO3
某校化学研究性小组,利用下列提供的实验装置和试剂对某种燃煤所
含元素进行定性和定量检测,试回答: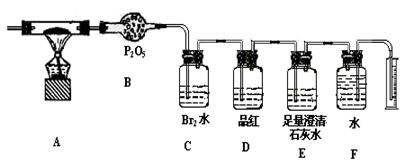
(1)将燃煤充分燃烧,产生气体经化学分析主要含有CO2、H2O、SO2、N2四种气体,则该燃煤一定含有的元素为.
(2)称取该燃煤样品Wg,通入纯氧使其充分燃烧,检测该燃煤中所含上述元素的质量分数。利用下列装置进行实验:
①指出上述装置中B、C、D、E的作用
BC
DE
②为了准确测量F中收集到的气体体积并能根据实验时温度、压强计算其物质的量,正确的实验操作是
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。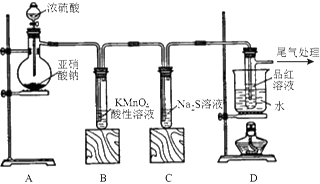
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是,A中发生反应的化学方程式为;
(2)实验过程中,装置B、C中发生的现象分别是、,这些现象分别说明SO2具有的性质是和;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象;
(4)尾气可采用溶液吸收。
I.现有下图所示装置,为实现下列实验目的,其中应以a端作为入口的是 。
A.瓶内盛碱石灰,用以干燥气体
B.瓶内盛饱和食盐水,用以除去Cl2中混有的少量HCl
C.瓶内盛水,用以测量某难溶于水的气体体积
D.瓶内贮存气体,加水时气体可被排出
E.收集密度比空气大的气体
F.收集密度比空气小的气体
II.欲用98%的浓硫酸(密度为1.84g·cm-3)配制浓度为1mol·L-1的稀硫酸480mL。
(1)从下列用品中 选出实验所需要的仪器
A.1000mL烧杯 B.100mL烧杯 C.10mL量筒 D.50mL量筒
E.500mL容量瓶 F.1000mL容量瓶 G.广口瓶H.托盘天平
(2)除选用上述仪器外,还缺少的必要仪器或用品是
(3)需取用浓硫酸的体积为mL (结果保留一位小数)
(4)下列情况中,会使所配溶液的浓度偏低的是
A.将量筒中的浓硫酸转入烧杯后,用水洗涤量筒,将洗液也转入在烧杯中
B.稀释浓硫酸后立即转入容量瓶
C.定容时加水不慎超过刻度线
D.定容时仰视刻度线
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。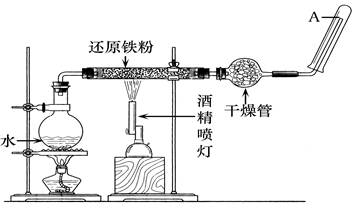
请回答该实验中的问题。
(1)写出该反应的化学方程式。
(2)实验前必须对整套装置进行的操作是。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是。
(4)干燥管中盛装的物质可以是,作用是。
(5)试管中收集到的气体是,如果要在A处玻璃管口处点燃该气体,则必须对该气体进行,这一操作的目的是 。
如下两个反应: A、NaOH+HCl=NaCl+H2O B、2FeCl3+Fe=3FeCl2
(1)根据两反应本质,分别判断能否用于设计原电池____________________________。其理由_________________________________________________________。
(2)如果可以,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子的流动方向,写出电极反应式。

________是正极,正极反应式:___________________;
________是负极,负极反应式:__________________。