下列关于NaHCO3的叙述,不正确的是( )
| A.它是一种白色粉末,溶解度小于Na2CO3 |
| B.加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 |
| C.与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 |
| D.它是一种碳酸盐 |
下列叙述正确的是()
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释10倍后pH=4 |
| C.0.2mol/L的盐酸与等体积水混合后pH=1 |
| D.常温下,pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
下列说法中,正确的是()
| A.ΔH>0 kJ/mol表示放热反应,ΔH<0 kJ/mol表示吸热反应 |
| B.1 mol H2SO4与1 mol Ba(OH)2反应时放出的热叫做中和热 |
| C.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数表示物质的量,所以可以是分数 |
反应N2O4(g) 2NO2(g)⊿H = +57KJ/mol,在温度为
2NO2(g)⊿H = +57KJ/mol,在温度为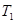 、
、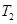 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ()
时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ()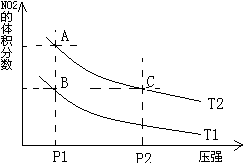
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
某探究小组在某温度下测定溶液的pH时发现:0.01 mol/L的NaOH的溶液中,由水电离出的C(OH-).C(H+) = 10-22 (mol/L)2,则该小组在该温度下测得0.1 mol/L NaOH溶液的pH应为 ()
| A.13 | B.12 | C.11 | D.10 |
将 和
和 充人恒容密闭容器中,恒温下发生反应: H2(g)+Br2(g)
充人恒容密闭容器中,恒温下发生反应: H2(g)+Br2(g) 2HBr(g) ⊿H <0,平衡时
2HBr(g) ⊿H <0,平衡时 的转化率为a.若初始条件相同,绝热下进行上述反应,平衡时
的转化率为a.若初始条件相同,绝热下进行上述反应,平衡时 的转化率为b。
的转化率为b。
则a与b的关系是()
| A.a>b | B.a=b |
| C.a<b | D.无法确定 |