某探究小组在某温度下测定溶液的pH时发现:0.01 mol/L的NaOH的溶液中,由水电离出的C(OH-).C(H+) = 10-22 (mol/L)2,则该小组在该温度下测得0.1 mol/L NaOH溶液的pH应为 ( )
| A.13 | B.12 | C.11 | D.10 |
下列说法正确的是
| A.2-甲基丙烷的一氯取代物有两种 |
B. 和 和 互为同系物 互为同系物 |
| C.顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 |
D.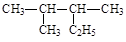 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
下列关于材料的说法中,正确的是
| A.光导纤维是信息社会必不可少的有机合成材料 |
| B.棉布、羊毛和涤纶燃烧后都只生成二氧化碳和水 |
| C.航天飞机上的陶瓷防护片属于新型无机非金属材料 |
| D.食品保鲜膜、塑料水杯等生活用品的主要成分是聚氯乙烯 |
下列与金属腐蚀有关的说法中,不正确的是
| A.钢铁在潮湿空气中生锈属于电化学腐蚀 |
| B.电化学腐蚀一般可分为吸氧腐蚀和析氢腐蚀 |
| C.金属腐蚀的本质是金属原子失去电子被氧化的过程 |
| D.铝具有很强的抗腐蚀能力,是因为其不易与氧气发生反应 |
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体VmL。下列说法正确的是
| A.铜电极连接电源正极 |
| B.黑色粉末X是铁粉 |
C.铜的相对原子质量的计算式是 |
| D.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O |
硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g)  4NO (g) + 6H2O (g)△H=" -" 9072 kJ·mol-1K= 1.1×1026
4NO (g) + 6H2O (g)△H=" -" 9072 kJ·mol-1K= 1.1×1026
② 4NH3 (g) + 4O2 (g)  2N2O (g) + 6H2O (g)△H=" -" 1105 kJ·mol-1K= 4.4×1028
2N2O (g) + 6H2O (g)△H=" -" 1105 kJ·mol-1K= 4.4×1028
③ 4NH3 (g) + 3O2 (g)  2N2 (g) + 6H2O (g)△H=" -" 1269 kJ·mol-1K= 7.1×1034
2N2 (g) + 6H2O (g)△H=" -" 1269 kJ·mol-1K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
| A.减小压强 | B.降低温度 |
| C.增大O2浓度 | D.使用合适的催化剂 |