最近发现一种有钛原子和碳原子构成的气态团簇分子,结构如图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为______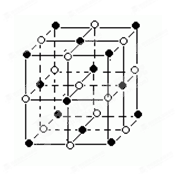
(1)下列各组物质:①金刚石和C60②H、D和T③乙烷和已烷④CH3(CH2)2CH3和(CH3)2CHCH3中,互为同位素的是(填序号,下同)__ ___,互为同素异形体的是_ __,互为同系物的是_____,属于同分异构体的是__ ___。
(2)请写出2,3-二甲基丁烷的结构简式: 。
(3)请用系统命名法命名该烷烃CH3CH(C2H5)CH(CH3)2: 。
(1)已知:
① 2H2(g)+O2(g)=2H2O(l) △H1=" -a" kJ•mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 =" -b" kJ•mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 =" -c" kJ•mol-1
CH3OH(g) △H3 =" -c" kJ•mol-1
计算甲醇蒸气的标准燃烧热 =
=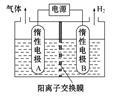
(2)利用LiOH和钴氧化物可制备锂离子电池正极材料。LiOH可由电解法制备,钴氧化物可通过处理钴渣获得。
①利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”)。
②利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下: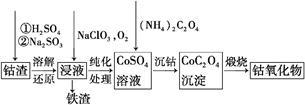
Co(OH)3溶解还原反应的离子方程式为 。
(1)砷(As)与其化合物被广泛应用在农药、除草剂、杀虫剂以及含砷药物中。回答下列问题:
①砷是氮的同族元素,且比氮多2个电子层,砷在元素周期表中的位置: ;AsH3的热稳定性比NH3的热稳定性 (填“强”或“弱”)。
②As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸
酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子
方程式 。
③As2S3和HNO3反应如下:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在 (填“正极”或“负极”)附近逸出,该极的电极反应式为 。
(2)综合利用CO2对环境保护及能源开发意义重大。Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ NA+ Cu2+ Al3+ |
| 阴离子 |
SO42- HCO3- OH-Cl- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成。根据上述实验填空:
(1)写出B、D的化学式:B ____,D 。
(2)C可用作净水剂,用离子方程式表示其净水原理____ ___。
(3)将含0.01 mol A的溶液与含0.02 mol E的溶液反应后,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是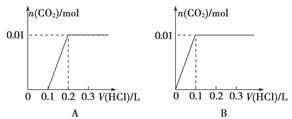
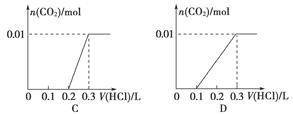
(4)在m mL B mol·L-1 C溶液中,加入等体积A mol·L-1的E溶液。当A≤3B时,生成沉淀的物质的量是 mol;当3B<A<4B件时,生成沉淀的物质的量是 mol。
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 |
Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 |
Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.取少量的废水于试管中,观察颜色,嗅气味,与普通水明显不同;
Ⅱ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅲ.若向II所得的溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅳ.若向II所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出IV的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH约为 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)