某工业废水中可能含有如下几种阴阳离子:
| 阳离子 |
Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 |
Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.取少量的废水于试管中,观察颜色,嗅气味,与普通水明显不同;
Ⅱ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅲ.若向II所得的溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅳ.若向II所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出IV的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH约为 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
I.短周期元素X、Y、Z在元素周期表中的位置如下图所示,其中Y元素原子的最外层电子数是电子层数的两倍。回答下列问题: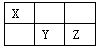
(1)Y元素在元素周期表中的位置是。
(2)列举一个事实证明Y元素与Z元素的非金属性强弱:。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐。该盐溶液的pH7(填“<”、“>”或“=”),其原因为(用离子方程式表示)。
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键。该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体。该反应的化学方程式为。
II.已知可逆反应:CO(g)+H2O(g) 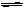 CO2(g)+H2(g),平衡常数见下表:
CO2(g)+H2(g),平衡常数见下表:
| 温度/℃ |
500 |
700 |
850 |
1 000 |
| 平衡常数 |
2.5 |
1.7 |
1.0 |
0.6 |
(5)该反应ΔH0(填“<”或“>”)。
(6)850 ℃时,若向一容积固定的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 molCO2和x mol H2,若要使上述反应开始时正向进行,则x应满足的条件是。
若x=5.0,当反应达到平衡时,n(H2)=。
(【化学—物质结构与性质】1)钠镁铝三种元素中第一电离能最大的是。
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为。
(3)Mn和Fe的部分电离能数据如表:
| 元素 |
Mn |
Fe |
|
| 电离能/kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是。
(4)①氨基乙酸铜的分子结构如图,碳原子的杂化方式为________。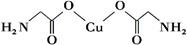
②金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是
(5)乙醇和二甲醚是同分异构体,但它们性质存在差异:
| 分子式 |
结构简式 |
熔点 |
沸点 |
水溶性 |
|
| 乙醇 |
C2H6O |
C2H5OH |
-114.3℃ |
78.4 °C |
互溶 |
| 二甲醚 |
C2H6O |
CH3OCH3 |
-138.5℃ |
-24.9℃ |
微溶 |
乙醇和二甲醚沸点及水溶性差异的主要原因是。
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体([Cu(NH3)4]SO4)析出,请画出呈深蓝色溶液的离子的结构简式(标出配位键);深蓝色晶体中不存在的微粒间作用力有。
A.范德华力
B.离子键
C.共价键
D.金属键
E.配位键
某校化学兴趣小组为探究FeSO4和NaHCO3的反应,按右图所示操作将NaHCO3溶液滴加到FeSO4溶液中(FeSO4和NaHCO3溶液均用经煮沸后冷却的蒸馏水配制,并在FeSO4溶液中加入少量铁粉)。观察到试管中立即出现白色沉淀,同时有大量无色气体生成。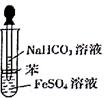
(1)实验室欲配制10%的NaHCO3溶液,所需仪器有:烧杯、玻璃棒、药匙、、(写出另外两种)。
(2)产生的气体是(填分子式)。
【查阅资料】FeCO3为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间才能被氧化为Fe(OH)3。
(3)关于白色沉淀的成分,小组同学提出如下假设,请补充完成假设3:
假设l:白色沉淀是Fe(OH)2;
假设2:白色沉淀是FeCO3;
假设3:白色沉淀是。
(4)若假设2成立,写出生成FeCO3的离子方程式:。
经煮沸后冷却的蒸馏水配制FeSO4溶液的目的是
某同学认为白色沉淀不可能为Fe(OH)2,你是否同意其观点?。(填“同意”或“不同意”)。
(5)请设计一个实验方案,验证假设2是否成立。。
连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?______________________________(填一注意事项)。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示: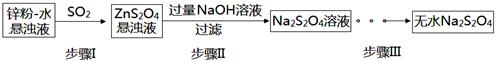
①步骤I中SO2表现了____________(填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________.
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3===____Na2S2O4↓+___H2O+_________
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。____________________________.
X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
(1)Y的原子结构示意图是_______________.
(2)甲的水溶液与硫酸铝溶液反应离子方程式.
(3)甲与氯化氢反应生成乙.乙所含化学键类型有.在0.1mol•L﹣1乙溶液中,所含离子浓度由大到小的顺序是.
(4)工业上,可通过如下转化制得尿素晶体:
①Ⅰ中恒温恒容条件下,能同时提高化学反应速率和NH3产率的是。
②反应Ⅱ:2NH3(g)+ CO2(g) CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
CO(NH2)2(g)+ H2O(g) △H1 =" -536.1" kJ·mol-1
(i)此反应的平衡常数表达式K=。升高温度,K值(填增大、减小或不变)。
(ii)尿素可用于处理汽车尾气。CO(NH2)2(g)与尾气中NO反应生成CO2、N2、H2O(g)排出。
已知:4NH3(g)+ 6NO(g)= 5N2(g)+ 6H2O(g) △H2 =" -1806.4" kJ·mol-1
写出CO(NH2)2(g)与NO反应的热化学方程式。