炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为________。
(3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:_______。
(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_________。
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=_____。已知:K(300℃)>K(350℃),该反应是________热反应。
(2)右图中表示NO2的变化的曲线是________。用O2表示从0~2s内该反应的平均速率v=______。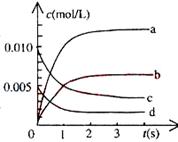
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
49gH2SO4含有分子_____________mol,含有O原子_______________个,含有S原子_______________g完全溶于水,配成2 L溶液,则所得溶液中H+的物质的量浓度为_____________________。
标准状态下质量比为14 :15的N2和NO气体,N2和NO的物质的量之比为____________,密度之比为______________如将其混合氮原子和氧原子的个数比为_________________。
(1)下列物质能导电的是,
属于电解质的是,
属于非电解质的是。
①水银②烧碱③大理石④氯化钠晶体⑤盐酸溶液⑥蔗糖
(2)按要求写出下列方程式:
①硫酸铝电离的电离方程式:
②碳酸钙与盐酸反应的离子方程式:
阅读下列材料,按要求回答问题
酒精、苯、CCl4、煤油都是有机溶剂,有机溶剂之间大都能互溶;碘(I2)难溶于水,易溶于有机溶剂,其溶液呈紫色;溴(液溴)的性质与碘相似,其溶液呈橙色。
(1)下列能用分液漏斗进行分离的是
| A.液溴和CCl4 | B.酒精和煤油 | C.CaCl2和Na2SO4 | D.苯和蒸馏水 |
(2)在酒精、苯、CCl4、NaCl、蒸馏水五种试剂中:
①能把碘单质从碘水中萃取出来的是,
进行分液之后是否能得到纯净的碘单质?
②能把溴从溴水中萃取出来,并在分液时溴从分液漏斗下端倒出的是;
萃取时,上层液体呈色,下层液体呈。
③CCl4能把碘酒中的碘萃取出来吗?;为什么?