阅读下文,并回答(1)~(3)小题。
20世纪90年代初,国际上提出了“预防污染”这一新概念。绿色化学是“预防污染”的根本手段,它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各五一节都实现净化和无污染的反应途径。
(1)下列各项属于“绿色化学”的是
A.处理废弃物 B.治理污染点
C.减少有毒物 D.杜绝污染源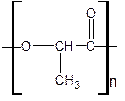 (2)在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重。最近研制出一种新材料聚乳酸:
(2)在国际环境问题中,一次性使用聚苯乙烯材料带来的“白色污染”极为严重。最近研制出一种新材料聚乳酸:
它能代替聚苯乙烯,它由乳酸聚合而成,能在乳酸菌的作用下,降解而消除对环境的污染。下列关于聚乳酸的说法正确的是
A. 聚乳酸的单体是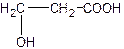
B. 聚乳酸的单体自身分子间在一定条件下能够相互反应生成环状化合物
C. 聚乳酸是一种羧酸
D. 单体聚合成聚乳酸的方式与单体聚合成聚苯乙烯的方式相同
(3)1996年美国罗姆斯公司的G.L.Willingham等人研制出对环境安全的船舶防垢剂──“海洋9号”而获得了美国“总统绿色化学挑战奖”。“海洋9号”的结构简式如下式:
试回答下列问题: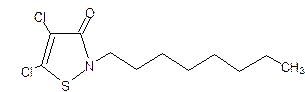
①“海洋9号”的化学式为________;
②“海洋9号”能在一定条件下与H2发生加成反应,写出“海洋9号”与足量氢气加成产物的结构简式 ;
③若“海洋9号”分子中的氢原子被一个氯原子取代,所得一氯取代物的种数为 。
(并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合价升降的化学反应都是氧化还原反应。现在如下氧化还原反应,回答下列问题:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)氧化剂是_________,氧化产物是________
(2)未变价元素是_______,将反应成离子方程式________
(3)用单线桥表示转移的电子数:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)氧化产物和还原产物的质量之比为___________________
(5)反应中生成3.6gH2O,转移电子数为_______个。
(6)已知铵盐受热易分解,硝酸铵在一定条件下发生的分解反应为:5NH4NO3=2HNO3+4N2↑+9H2O,当生成还原产物0.6mol时,转移的电子的物质的量是_________mol。
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x="______" .Fe(CO)x在一定条件下发生反应:
Fe(CO)x(s) Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为 。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为 。
(3)写出CO的一种常见等电子体分子的结构式______;两者相比较沸点较高的为______(填化学式).CN-中碳原子杂化轨道类型为 ,S、N、O三元素的第一电离能最大的为 (用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图所示。
①基态铜原子的核外电子排布式为 。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为 g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
下图是传统的工业生产金属铝的基本流程图。结合铝生产的流程图回答下列问题:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品__________(填物质名称)作电解铝的阴极和阳极材料。
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是________
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式________________。若电解的总反应为2Al2O3+3C 3CO2+4Al,则阳极的电极反应式为_______________。
3CO2+4Al,则阳极的电极反应式为_______________。
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式______________。
(5)已知生产1mol铝消耗的电能为1.8x106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=_____________。(热回收效率= 回收能量/生产耗能x100%)
碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1) 实验室中制取少量碘可采用如下方法:
KI + CuSO4 → A (白色)↓+ K2SO4 + I2
16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式: 。工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3反应后生成碘,写出此反应的离子方程式: 。
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O  H3O++ OH-),生成的阳离子为 ;阴离子为 。
H3O++ OH-),生成的阳离子为 ;阴离子为 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式: , 。
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为_________mol·L-1(精确到0.01)。
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HC1等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式: 。
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
2NO,是导致汽车尾气中含有NO的原因之一,科学家设计利用NH3在催化条件下将NOx还原成N2而排放。
①在T1、T2温度下,一定量的NH3发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ 3H2(g) 2NH3(g)的△H_______0(填“>”或“<”)。
2NH3(g)的△H_______0(填“>”或“<”)。
②在 温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
温度下,向2L密闭容器中充入10molN2与5mo1H2,50秒后达到平衡,测得NH3的物质的量为2mol,则该反应的速率v(N2)___________________。该温度下,若增大压强此反应的平衡常数将_______________(填“增大”、“减小”、“不变”或“无法确定”);若开始时向上述容器中充入N2与H2均为10 mol,则达到平衡后H2的转化率将__________。(填“升高”、“降低”)
(2)利用图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。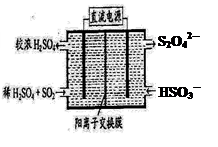
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。
L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_________(用含a和b的代数式表示)。