在如右图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )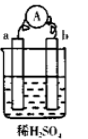
| A.碳棒上有气体放出,溶液酸性变弱 |
| B.a是正极,b是负极 |
| C.导线中有电子流动,电子流向从a极到b极 |
| D.a极上发生了氧化反应 |
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
| A.Na+、K+、OH-、Cl- |
| B.Na+、Cu2+、SO42-、NO3- |
| C.Mg2+、Na+、SO42-、Cl- |
| D.Ba2+、HCO3-、NO3-、K+ |
用NA表示阿佛加德罗常数,下列说法正确的是
| A.标准状况下,2.24L水所含的分子数为0.1 NA |
| B.常温常压下,1.6gO2和O3混合气体中原子总数为0.1 NA |
| C.0.3 mol /L的BaCl2溶液中含Ba2+数目为0.3 NA |
| D.1mol氯气参加氧化还原反应,转移的电子数一定为2 NA |
下列离子方程式中,错误的是
| A.碳酸钠溶液跟足量稀H2SO4混合:CO32﹣+2H+=H2O+CO2↑ |
| B.硝酸铜溶液中滴加烧碱溶液:Cu2++2OH﹣=Cu(OH)2↓ |
| C.次氯酸溶液中加入氢氧化钾溶液:H++OH﹣=H2O |
| D.碳酸钙溶于醋酸CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑ |
下列叙述正确的是
| A.实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 |
| B.SO3溶于水能导电,但它是非电解质 |
| C.有单质参加同时有单质生成的反应一定属于氧化还原反应 |
| D.不与酸反应的氧化物一定会跟碱反应 |
下列关于物质分类的正确组合是
| |
碱 |
酸 |
盐 |
碱性氧化物 |
酸性氧化物 |
| A |
氨气 |
硫酸 |
小苏打 |
氧化钙 |
干冰 |
| B |
烧碱 |
盐酸 |
食盐 |
氧化钠 |
一氧化碳 |
| C |
石灰水 |
冰醋酸(CH3COOH) |
胆矾 CuSO4·5H2O |
过氧化钠 |
二氧化硫 |
| D |
NH3·H2O |
HNO3 |
碳酸钙 |
氧化铁 |
SO3 |