向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
| A.a点发生反应的离子方程式是: Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| B.b点消耗Ba(OH)2溶液体积为200mL |
| C.从a→b 、b→c点过程中发生反应的离子方程式依次为:NH4++OH-=NH3·H2O Al(OH)3+OH-=AlO2-+2H2O |
| D.沉淀的质量:a点>c点 |
关于下列各组物质的相互关系,判断正确的是()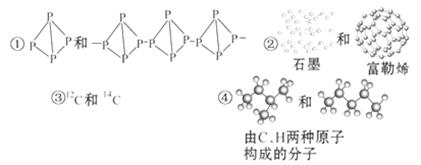

| A.互为同素异形体的是①② | B.互为同位素的是②③ |
| C.互为同一物质的是①⑤ | D.互为同分异构体的是④⑤ |
下列说法不正确的是()
| A.粘有油脂的试管可以用热的纯碱溶液洗涤 |
| B.石油的分馏、裂化、裂解都是化学变化 |
| C.食醋中含有乙酸,乙酸可由乙醇氧化得到 |
| D.煤可与水蒸气反应制成水煤气,水煤气的主要成分为CO和H2 |
下列除去杂质(括号内物质为少量杂质)的方法中,正确的是()
| A.乙烷(乙烯):光照条件下通入Cl2,气液分离 |
| B.乙酸乙酯(乙酸):用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏 |
| C.CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶 |
| D.乙醇(乙酸):加足量浓硫酸,蒸馏 |
某有机物4.6克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与8.8克,该有机物可能是()
| A.CH4 | B.C2H4 | C.C2H6 | D.C2H6O |
下列用水就能鉴别的一组物质是()
| A.苯、己烷、四氯化碳 | B.苯、乙醇、四氯化碳 |
| C.苯、乙醇、乙酸乙酯 | D.硝基苯、乙醇、乙酸 |