在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题: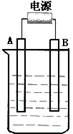
(1)A接的是电源的 极,B是该装置 。
(2)写出电解时反应的总离子方程式 。
(3)电解后溶液的pH为 ;要使电解后溶液恢复到电解前的状态, 则需加入 ,其质量为 。(假设电解前后溶液的体积不变)
[化学—选修3:物质结构与性质]早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: ,可用硫氰化钾检验三价铁离子,形成配合物的颜色为 。
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ,一摩尔乙醛分子中含有的σ键的数目为 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm(晶胞参数就是晶胞立方体的边长),晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为: ;
(2)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为__ ;
(3)COCl2的分解反应为COCl2(g)= Cl2(g)+ CO(g) △H =" +108" kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
①计算反应在第8 min时的平衡常数K = __________(保留小数点后三位)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、“>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v (2—3)、v(5—6)、v (l2-13)表示]的大小___________;
⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小:v (5-6) v(15-16)(填“<”、“>”或“=”),原因是____________。
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料,有关数据下图所示:
溶解度/(g/100g水)
| 化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的负极为 ,正极反应式为 ,
(2)维持电流强度为0.5A,电池工作5分钟,理论消耗Zn g(已知F=96500C/mol)。
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过 分离回收,滤渣的主要成分是二氧化锰、 和 ,欲从中得到较纯的二氧化锰,最简便的方法是 ,其原理是 。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入稀硫酸和双氧水,溶解,铁变为 加碱调节PH为 ,铁刚好完全沉淀(离子浓度≤1×10-5mo1·L-1时即可认为离子沉淀完全)继续加碱调节PH为 锌开始沉淀(假定此时溶液中Zn2+的浓度为0.1 mo1·L-1)。若上述过程不加双氧水的后果 ,原因是 。
某饮料果醋的成分之一M的结构简式为: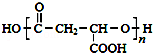 ,合成M的流程图如下:
,合成M的流程图如下: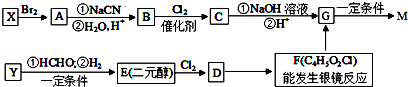
已知:①X、Y都是烃,在核磁共振氢谱图上都只有一个峰
②RC≡CH+HCHO RC≡C﹣CH2OH
RC≡C﹣CH2OH
③RCH2Br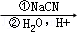 RCH2COOH
RCH2COOH
请回答下列问题:
(1)有机物C的系统命名为 。
(2)实验室制备Y的化学方程式为 。由F制G可能发生的有机反应类型为 。
(3)D含有的官能团名称是 。
(4)写出下列反应的化学方程式
①由G制备M 。
②F和足量的碱性新制氢氧化铜悬浊液 。
(5)T是G的同分异构体,T含有三种含氧官能团:羧基、羟基和醛基,两个羟基不连在同一个碳原子上。写出T可能的结构简式 。
(15分) A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大。A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1 ="578" kJ/mol,I2="1" 817 kJ/mol,I3=" 2" 745 kJ/mol,I4 ="11" 575 kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34。请回答下列问题:
(1)AY2是一种常用的溶剂,为 分子(填“极性”或“非极性”),分子中存在 个σ键。
(2)X形成的单质与NaOH溶液反应的离子方程式为 超高导热绝缘耐高温纳米XB在绝缘材料中应用广泛,其晶体与金刚石类似,属于 晶体。B的最简单氢化物容易液化,理由是 。
(3)X、氧、B元素的电负性由大到小的顺序为 (用元素符号作答) 。
(4)Z的基态原子核外电子排布式为 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2, HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示不正确的是 (填序号)
①氧化剂是O2
②HO2在碱中不能稳定存在
③氧化产物是HO2
④1 mol Z参加反应有1 mol电子发生转移
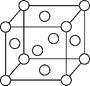
(5)已知Z的晶胞结构如下图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 cm。ZYO4常作电镀液,其中YO42-的空间构型是 ,Y原子的杂化轨道类型是 杂化。