胆矾是一种重要工业用盐,如电镀工业用作全光亮酸性镀铜主盐和铜离子添加剂。印染工业用作媒染剂和精染布的助氧剂。农业上作为杀菌剂。某研究小组拟用废旧铜器(主要杂质为含铁的化合物)来制备胆矾。设计流程如下:
pH值控制可参考下列数据
| 物质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
| 氢氧化铁 |
2.7 |
3.7 |
| 氢氧化亚铁 |
7.6 |
9.6 |
| 氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)试剂A可选用_____(填字母)。
a.稀H2SO4 b.浓H2SO4 c.浓FeCl3溶液 d.浓HNO3
(2)第②步加入H2O2溶液发生的反应的离子方程式为:_____________________________。
(3)第③步中所加试剂B为________(填化学式)。调节溶液的pH合适的范围是__________。
(4)操作⑤通常加H2SO4调节pH=1是为了:______________________________________。
(5)本流程中多次用到过滤操作,该操作主要用到的玻璃仪器为: _______________,操作⑥的主要步骤为: 、 。
(6)某同学认为上述流程中所加的试剂A并不理想,需作改进,其理由是______________
__________________________________________________________。请你帮助提出一条改进方案____________ 。
下表是元素周期表中短周期元素部分,表 中字 母分别代表一种元素:
| a |
b |
||||||
| d |
e |
f |
|||||
| c |
g |
h |
上述元素(填元素名称) 可以形成硬度最大的单质。
⑵“神舟”六号飞船内需要有一种化合物来吸收宇航员呼出的 CO2,并释放出O2,你认为该
物质应该是由上表中的和元素(填元素名称)组成的。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气 体用于稀释氧气,该气体分子是。(填化学式)
表中元素g的氢化物稳定性比元素e的氢化物的稳定性(填“强”或“弱”)。
⑷将潮湿的由h元素构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试 剂可能是。(填数字序号)
①浓硫酸②NaOH溶液 ③KCl溶液④饱和食盐水
⑸写出h元素构成的单质与水反应的化学方程式:。
如图是几种烷烃的球棍模型,试回答下列问题: 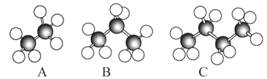
⑴A、B、C三者的关系是。
⑵A的分子式为,C的名称为。
⑶写出C 的同分异构体的结构简式。
在原子序数1—18号元素 中,按要求用合适的化学用语填空:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是___________。
(4)最稳定气态氢化物的化学式是______________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_______________。
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA- HA- H++A2-完成以下问题:
H++A2-完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+ CO32- CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=(计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K=(计算结果保留三位有效数字)
下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题: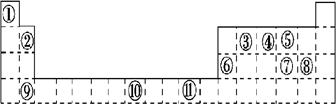
(1)表中属于ds区的元素是_____ (填编号)。
(2)  其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有元素(填元素符号)。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子成对电子为_ _对。
(4)比较下列数值的大小(选填“>”“<”“=”)
第一电离能:④⑤;电负性:⑦⑧