某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA- HA- H++A2- 完成以下问题:
H++A2- 完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+ CO32- CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)
(16分)
(1)1840年前后,瑞士科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知,在101 kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3 kJ·mol-1、285.8 kJ·mol-1和393.5 kJ·mol-1,则反应C(s)+2H2(g)= CH4(g)的反应热ΔH=__________,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义?__________。
(2)已知:2H2(g)+O2(g)====2H2O(g) ΔH1
2H2(g)+O2(g) ====2H2O(l)ΔH2
2CO(g)+O2(g)====2CO2(g)ΔH3
①写出液态水转化为气态水的热化学方程式:___________________________________。
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是__________。
(14分)某化学反应2A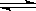 B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率V(B)为mol/(L·min)。
(2)在实验2,A的初始浓度C2=mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3V1(填>、=、<),且C31.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是反应(选填吸热、放热)。
(14分)反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是(填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率,逆反应速率。
③保持体积不变,充入N2使体系压强增大,其正反应速率,逆反应速率。
④保持压强不变,充入N2使容器的体积增大,其正反应速率,逆反应速率。
X、Z、Q、R 4种短周期元素原子序数的依次增大,Y是一种短周期主族非金属元素。化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol·L-1甲溶液的pH=13。工业上常用电解QR饱和溶液生产甲。请填写下列空白。
(1)Q的原子结构示意图为。
(2)电解QR饱和溶液反应的离子方程式为。
(3)常温下将R的单质通入甲溶液中,发生反应的离子方程式为。
(4)①若Y与X组成的气体化合物乙在常温下遇XR气体时产生白烟,则乙的化学式为;YZ2与水反应的化学方程式:________________________________________
②若Y元素的单质能发生如图所示转化,则Y元素名称是。YZ2的结构式为:_____________YZ2通过置换反应可生成Y的单质,该反应式为:____________________________________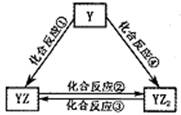
③若Y元素的单质是一种淡黄色固体。写出Y的最高价氧化物的水化物的浓溶液与铜共热的化学方程式:______________ ____________________________________
④若Y的最高价氧化物可制光导纤维。写出工业生产Y单质的反应的化学方程式:____________________________________________________________
已知化合物A和金属单质B反应生成C和D的同时放出大量的热;若将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色液体。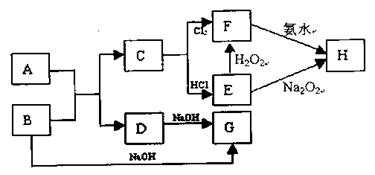
请回答下列问题:
(1)红褐色液体中H粒子的直径大小范围。
(2)写出D、E的化学式:D、E
(3)写出H2O2的电子式:,及E的酸性溶液与双氧水反应的离子方程式。
(4)写出B→G反应的化学方程式:
(5)写出F溶液中阳离子检验方法:
离子方程式为。