天然维生素P(结构如图,其中烃基R为饱和烃基)存在于槐树花蕾中,它是一种营养
增补剂。关于维生素P的叙述错误的是( )
| A.可以使酸性KMnO4溶液褪色 |
| B.分子中有三个苯环 |
| C.1mol维生素P可以和4molNaOH反应 |
| D.维生素P与溴水反应时1mol维生素P可以消耗6molBr2 |
已知N2O4 (g) 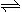 2NO2 (g)ΔH<0,
2NO2 (g)ΔH<0,
(1)现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。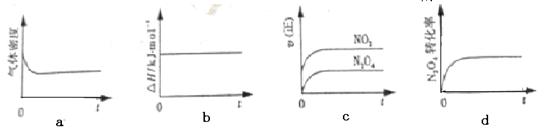
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”、“不变”或“减小” )。反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·S-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是(用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动。
(11分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色退去。现有一个氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是______,化合价没有发生变化的反应物是______。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)_____________________。
(3)上述反应中,氧化剂是_______,1 mol氧化剂在反应中________(填“得到”或“失去”) ____mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。说出NaBiO3的一个性质:______________________________。
原子序数依次增大的短周期元素a、b、c、d、e,其中a的最外层电子数为其周期数的二倍;b和d在同一主族,且均能形成的A2B型氢化物,c的+1价离子比e的-1价离子少8个电子。回答下列问题:
(1)元素a的名称为:________;元素e的简单离子的结构示意图:;元素c的两种氧化物的化学式为、。
(2)由这些元素形成的双原子分子有__________________。
(3)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为。
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是______________。
(2)为防止氯气尾气污染空气,根据氯水显酸性的性质, 可用溶液吸收多余的氯气,原理是(用化学方程式表示)_________。根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是______(填化学式)
(3)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继
发生氯气泄漏和爆炸事故。截至记者发稿时,已有9人在事故中失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是。
| A.NaOH | B.NaCl | C.KBr | D.Na2CO3 |
向一金属易拉罐内(内空)放入一匙某白色晶体(CO2的固体——干冰),摇动几下后,立即注入6mol/L过量的氢氧化钠溶液,用胶布密封罐口。过一段时间后,罐壁变瘪;再过一段时间后,瘪了的罐壁又重新鼓了起来。
⑴要产生上述实验现象,做易拉罐的金属是;
⑵罐壁变瘪的原因是,
离子方程式是;
⑶罐壁再度鼓起的原因是 ,