下列离子能在溶液中大量共存的是
| A.Na+、NH4+、CO32-、Br- | B.Fe2+、H+、ClO-、Cl- |
| C.Al3+、Ca2+、HCO3-、SO42- | D.Fe3+、Cu2+、NO3-、OH- |
据报道,一科学小组由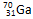 和
和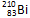 两原子经核聚合,并放出一定数目的中子而制得质量数为275,质子数为114的某原子。则两原子在核聚合过程中放出的中子数目是
两原子经核聚合,并放出一定数目的中子而制得质量数为275,质子数为114的某原子。则两原子在核聚合过程中放出的中子数目是
| A.161 | B.5 | C.166 | D.52 |
熔融烧碱样品应使用下列哪种器皿
| A.石英坩埚 | B.氧化铝耐高温坩埚 | C.生铁坩埚 | D.瓷坩埚 |
下列有关试剂的保存方法,错误的是
| A.碘保存在棕色细口玻璃试剂瓶中 |
| B.少量的钠保存在煤油中 |
| C.新制的氯水通常保存在棕色细口玻璃试剂瓶中 |
| D.氢氧化钠溶液用带橡胶塞的试剂瓶贮存 |
下列生活中的化学现象与氧化还原知识有关的是
| A.用食醋可以洗水垢(主要成分为CaCO3、Mg(OH)2) |
| B.蔗糖放在水中片刻后消失了 |
| C.菜刀洗过后如果没擦干放置一段时间就会出现斑点 |
| D.稀盐酸洒在大理石台面上产生大量气泡 |
为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是
| A.Na+ | B.Ca2+ | C.Mg2+ | D.Fe3+ |