脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是_______。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子。含SO2的烟气可利用海水脱硫,其工艺流程如下图所示: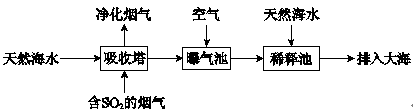
①向曝气池中通入空气的目的是_______。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是_______。
a.Cl- b.SO42- c.Br- d.HCO3-
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
①图中a极要连接电源的(填“正”或“负”)_______极,C口流出的物质是_______。
②SO32-放电的电极反应式为_______。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_______。
(12分)(1)现有CH4、C3H4、C2H4、C2H6、C3H6五种有机物。同质量的以上物质中,在相同状况下体积最大的是_________;同质量的以上物质完全燃烧时耗去O2的量最多的是_________;同状况、同体积的以上五种物质完全燃烧时耗去O2的量最多的是_________;同质量的以上五种物质燃烧时,生成CO2最多的是_________,生成水最多的是_________。在120 ℃、1.01×105 Pa状态下,有三种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这三种气体是___________。
(2)某烃含碳的质量分数约为90.5%。在相同条件下,其蒸气密度为空气密度的3.66倍,则其分子式为_________。
①若该烃硝化时,一硝基取代物只有一种,则该烃的结构简式为_________。
②若该烃硝化时,一硝基取代物只有两种,则该烃的结构简式为_________。
③若该烃硝化时,一硝基取代物只有三种,则这三种一硝基取代物的结构简式为_________、_________、_________。
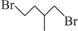
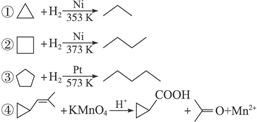
(8分)环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。下面是部分环烷烃及烷烃衍生物的结构简式、键线式和某些有机化合物的反应式(其中Pt、Ni是催化剂)。
| 结构简式 |
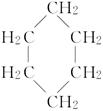 |
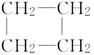 |
Br—CH2—CH2—CH (CH3)—CH3—Br |
| 键线式 |
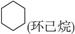 |
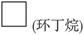 |
 |
完成下列问题:
(1)环烷烃与___________是同分异构体。
(2)从反应①—③可以看出,最容易发生开环加成反应的环烷烃是(填名称)。判断依据为______________________。
(3)环烷烃还可与卤素单质、卤代氢发生类似的开环加成反应,如环丁烷与HBr在一定条件下反应,其化学方程式为_____________________ (不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法。试剂________;现象与结论
_____________ _________。
(8分)已知: 可简写为
可简写为 ,降冰片烯的分子结构式可表示为
,降冰片烯的分子结构式可表示为 。
。
(1)降冰片烯属于_________。
a.环烃 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为_________。
(3)降冰片烯的一种同分异构(含有一个六元环的单环化合物)的结构简式为___________。
(4)降冰片烯不具有的性质_________。
| A.能溶于水 |
| B.能发生氧化反应 |
| C.能发生加成反应 |
| D.常温常压下必为气体 |
(10分)烃A1、A2互为同分异构体,它们各加1 mol H2都可得到烃B。A1、A2各加1 mol HCl都得到C1。而B在光照下与氯气反应,只得到两种一氯代物C1和C2。其转化关系如下所示。B中碳的质量分数为83.7%。
则A1、A2、B和C1、C2的结构简式分别是:
A1_______________________,A2_______________________,B__________________________,C1_______________________,C2_______________________。
400 K,1.01×105 Pa时,2 L烃A的蒸气能在m L O2中完全燃烧,反应后的体积增至(m+4) L。(体积均在相同条件下测定)
(1)烃A的组成应满足的条件是___________________。
(2)当m=15的时候,该烃可能的分子式为___________________。
(3)若A在常温常压下为气态,m的取值范围是___________________。