有Fe2+﹑NO3-﹑Fe3+、NH4+﹑H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
| A.氧化剂与还原剂的物质的量之比为8∶1 |
| B.还原产物为NH4+ |
| C.若有1 mol NO3-参加还原反应,则转移8mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+—e-= Fe3+ |
用标准的NaOH溶液滴定未知浓度的盐酸,若测定结果偏低,其原因可能是
| A.盛装标准液的滴定管未用标准液润洗 |
| B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 |
| C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 |
| D.滴定前无气泡,滴定到终点时,发现尖嘴处有气泡 |
用已知浓度的NaOH滴定未知浓度的HCl溶液时,正确的操作顺序是
①用水洗净滴定管
②将滴定管进行检漏
③用待装液润洗滴定管后装液
④调整起始读数并记录
⑤向锥形瓶中加入指示剂
⑥用标准液进行滴定
⑦从酸式滴定管中取一定体积的待测液
⑧记录滴定终点读数并重复实验2~3次
| A.①②③④⑤⑥⑦⑧ | B.①②③④⑦⑤⑥⑧ |
| C.②①③④⑦⑤⑥⑧ | D.②①③④⑤⑥⑦⑧ |
若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+Na+ Cl-AlO2- | D.K+ NH4+ SO42-NO3- |
下列有关水的电离的说法正确的是
| A.将水加热,KW增大,pH不变 |
| B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大 |
| C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小 |
| D.向水中加入少量NaOH固体,恢复到原温度,水的电离被抑制,c(OH-)增大 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随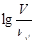 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当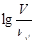 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则  增大 增大 |