下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
下表为部分短周期主族元素的相关信息。
| 元素 |
相关信息 |
| T |
T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
X的原子最外层电子数是其内层电子数的三倍 |
| Y |
在第三周期元素中,Y的简单离子半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
请回答下列问题:
(1)Z元素在元素周期表中的位置是第________周期第________族。
(2)元素T与X按原子个数比1∶1形成的化合物B所含的化学键有________(填化学键类型)。已知在通常状况下,39 g B与足量H2O反应放出Q kJ的热量,写出该反应的热化学方程式:__________________。
(3)将T的最高价氧化物对应水化物的溶液,逐滴加入到Y与Z形成的化合物的水溶液中,直至过量(边滴加边振荡),此过程中的现象是________________________。
(4)已知1 mol化合物A与足量Na2SO3在溶液中发生反应时,转移2 mol电子,写出该反应的离子方程式:_______________________________________。
如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如下图。已知甲、乙两室中气体的质量之差为10.9g。
(1)甲室中气体的物质的量为。
(2)甲室中气体的质量为。
(3)甲室中NH3,H2的物质的量之比为。
(4)将隔板a去掉,发生下列反应:HCl(g)+NH3(g)=NH4Cl(s),当HCl与NH3充分反应后,活塞b将位于刻度“”处(填数字)。
【化学——选修5:有机化学基础】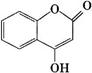 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成:
(1)A与银氨溶液反应有银镜生成,写出该反应的离子方程式 ;。
(2)B→C的反应类型是______________________________________。
(3) 写出D→E的化学方程式: _____________________________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式: _______________________________________。
(5)下列关于G的说法正确的是_____。
| A.能与溴单质反应 | B.能与金属钠反应 |
| C.1 mol G最多能和3 mol氢气反应 | D.分子式是C9H6O3 |
(6)E的同分异构体很多,除E外符合下列条件的共种。
①含苯环且能与氯化铁溶液显色, ②苯环上有两个取代基, ③含酯基。
(7)F分子中有种不同化学环境的氢原子
【化学——选修物质结构与性质】X、Y、Z、M、N、Q 、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
(1)X元素在周期表中的位置是,它的外围电子的电子排布图为。P元素属于区元素,
(2)XZ2分子的空间构型是,YZ2分子中Y的杂化轨道类型为,相同条件下两者在水中的溶解度较大的是(写分子式),理由是 ____________________。
(3)含有元素N的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol。
求该晶胞密度的计算式为g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示。
三聚氰胺分子中氮原子轨道杂化类型是 ,
1 mol三聚氰胺分子中 σ键的数目为 。
(15分)【化学—选修化学与技术】
印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入。硫磺可用于生产化工原料硫酸。某工厂用下图所示的工艺流程生产硫酸:
请回答下列问题:
(1)为充分利用反应放出的热量,接触室中应安装______________(填设备名称)。吸收塔中填充有许多瓷管,其作用是_____________________________________________。
(2)为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。
假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为__________
(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
(3)与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(4)硫酸的用途非常广,可应用于下列哪些方面__________________________。
A.橡胶的硫化 B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产 D.过磷酸钙的制备
(5)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式________________________________。