由铁矿石生产金属铁有两种可能的途径:
①Fe2O3(s)+3∕2C(s)="=2Fe(s)+" 3∕2CO2(g)
△H=231.93kJ·mol-1 △S=276.32J·mol-1·K-1
②Fe2O3(s)+3H2(g)==2Fe(s)+3H2O(g)
△H=96.71kJ·mol-1 △S=138.79J·mol-1·K-1
(1)试判断这两个反应在高温还是低温下自发进行 。
(2)上述反应中的 (填序号)可以在较低温度下进行。
阳极反应式:2CO+2CO
 4CO2+4e-
4CO2+4e-
阴极反应式:,总电池反应式:。
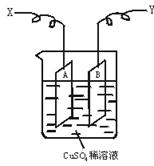
(1)当以I="0.21" A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则图装置中的X端应与直流电的__________极相连,它是电解池的__________极。
(2)电解后铜片B的质量__________。(答“增加”“减少”或“不变”)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
CO2+4H2 ()+2H2O
()+2H2O
若将CO2与H2混合,在一定条件下以1∶3的比例发生反应,生成某种重要的化工原料和水。该化工原料可能是
| A.烷烃 | B.烯烃 | C.炔烃 | D.芳香烃 |

(2)请写出一个化合物的结构式。它的分子式也是C8H9NO2,分子中有苯环,苯环上有三个取代基,其中之一为羧基,但并非上述二甲苯的硝化产物。请任写一个:。

试写出:
(1)A的分子式。
(2)与G同类的同分异构体(含G)可能有种。