设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1mol Cl2溶于足量水中转移电子数为NA |
| B.在熔融状态下,1molKHSO4完全电离出的阳离子数为2NA |
| C.标准状况下,22.4LNO与CO2的混合气体中含有的原子数为2NA |
| D.CaC2含有的π键的数目为0.2NA |
废弃的电子产品称为电子垃圾,其中含铅、汞等有害物质、危害严重。下列对电子垃圾处理应予提倡的是()
①将电子垃圾掩埋地下
②改进生产工艺,减少有害物质使用
③依法要求制造商回收废旧电子产品
④将电子垃圾焚烧处理
| A.①③ | B.②④ | C.①④ | D.②③ |
下列物质中属于非电解质的是()
| A.氯化钾的水溶液 | B.液态氯化氢 |
| C.气态甲烷 | D.作电极的碳棒 |
NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下: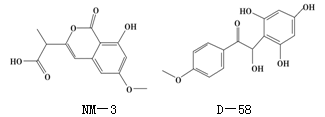
关于NM-3和D-58的叙述,错误的是()
| A.都能与NaOH溶液反应,原因不完全相同 |
| B.都能与溴水反应,原因不完全相同 |
| C.都不能发生消去反应,原因相同 |
| D.遇FeCl3溶液都显色,原因相同. |
褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。下列说法不正确的是()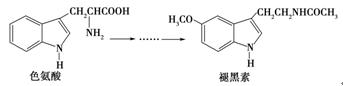
| A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 |
| B.在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
| C.在一定条件下,色氨酸可发生缩聚反应 |
| D.褪黑素与色氨酸结构相似,也具有两性化合物的特性 |
下列各项中的两种物质无论以何种比例混合,只要混合物的总物质的量一定.则完全燃烧时生成水的质量和消耗O2的质量均不变的是()
| A.C3H6、C3H8O | B.CH4O、C2H4O3 |
| C.C2H2、C6H6 | D.C3H6、C2H6O |