(10分)氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度 (填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中
2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是 。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。
则该反应的热化学方程式是 。
(4)右图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。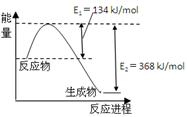
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=N2(g)+2CO2(g) △H=-112.3kJ/mol
则反应:2NO(g)+CO(g) N2(g)+2CO2(g)的△H是 。
N2(g)+2CO2(g)的△H是 。
按要求填空:有下列物质:①O2;②CO2;③NH3;④Na2O ;⑤Na2O2;⑥NaOH;⑦CaBr2;⑧H2O2;⑨NH4Cl ;⑩HBr,回答下列问题:
(1)只含有极性键的是;
(2)只含有非极性键的是;
(3)含有极性键和非极性键的是;
(4)只含有离子键的离子化合物是;
(5)含有非极性键的离子化合物是。
已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上的气态化合物,则:
(1)写出下列元素名称:X是________,Z是________。
(2)由Y和Z组成,且Y和Z的质量比为7∶20的化合物的分子式是________。
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的阴、阳离子分别为_____和_____,其中阴离子的电子式为______________。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4∶2∶3,该盐的化学式是__________;如果向该盐溶液中加入铜和稀硫酸,溶液变蓝色,试写出离子方程式______________________;如果将该盐固体与熟石灰混合加热,会产生一种刺激性气味的气体,试写出化学方程式__________________。
A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为。D在周期表中位置 。
(2)写出E的电子式:。
(3)A、D两元素形成的化合物属 (填“离子”或“共价”)化合物。
(4)写出D的最高价氧化物的水化物和A反应的化学方程式:。
相对分子质量不超过100的有机物A,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 A完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。
①其A相对分子质量为。 (结果四舍五入取整数)
经核磁共振检测发现A的图谱如下: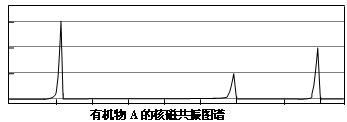
②试写出A的结构简式:____________________________。
③试写出A与甲醇反应生成有机物B的化学反应方程式:。
④B在一定条件下可以反应生成高分子化合物—有机玻璃,写出反应的方程式:。
⑤B的同分异构体有多种,请写出一种和B同类别的同分异构体的结构简式。
在某有机物A的分子中,其结构简式如下图。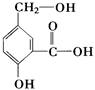
(1)A跟NaOH溶液反应的化学方程式是
(2)A跟NaHCO3溶液反应的化学方程式是
(3)A在一定条件下跟Na反应的化学方程式是: