(共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④VC- mol
mol
已知A、B、C、D、E、F六种元素的原子序数依次递增,前四种元素为短周期元素。A位于元素周期表s区,基态原子中电子层数与未成对电子数相等;B基态原子中电子占据三种能量不同的原子轨道,且每种能量不同的原子轨道中的电子数相同;C基态原子核外成对电子数为未成对电子数的3倍;D与C同主族;E、F位于同一周期和同一族,且E比F的核电荷数小2。
(1)E3+的核外有个未成对电子,A2C2的电子式为。
(2)F(BC)n的中心原子价电子数与配体提供电子总数之和为18,则n=________。
(3)B的一种氢化物分子中共有14个价电子,该分子中存在的共价键类型有。(填代号)
A.非极性键 B.极性键 C. s—sσ键 D.s—pσ键
E.p—p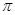 键 F.s—sp3σ键 G.sp3—sp3σ键 H.sp3—sp3 π键
键 F.s—sp3σ键 G.sp3—sp3σ键 H.sp3—sp3 π键
(4)A2D和A2C2的主要物理性质比较如下:
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| A2D |
187 |
202 |
2.6 |
| A2C2 |
272 |
423 |
以任意比互溶 |
A2D和A2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
。
X、Y、Z三元素的原子序数依次增大,三原子的核外最外层电子排布均为4s1。
(1)X元素组成的单质的晶体堆积模型为___________(填代号)。
a.简单立方堆积 b.体心立方堆积
c.六方最密堆积 d.面心立方最密堆积
(2)Y元素在其化合物中最高化合价为________;YO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断YO2Cl2是__________(填“极性”或“非极性”)分子。
(3)ZCl微溶于水,但能溶解在氯化钾的浓溶液中,原因 是。
(4)ZCl的晶胞结构如图所示,已知晶胞边长为a pm,密度为ρ g/cm3,则阿伏加德罗常数可表示为(列式表示)。
(5)已知ZnS的晶体结构与ZCl相似,下表列出了离子半径和熔点数据,解释ZnS和ZCl的熔点差异的主要原因。
| r(Zn2+) |
r(Z+) |
r(S2-) |
r(Cl-) |
熔点 |
|
| ZnS |
ZCl |
||||
| 74pm |
77pm |
184pm |
181pm |
1700℃ |
430℃ |
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐。
(1)该反应的化学方程式为。
(2)N、F两种元素的氢化物稳定性比较,NH3HF(选填“>“或”<“)。
(3)N3- 被称为类卤离子,写出一种与N3-互为等电子体的分子的化学式,N3-的空间构型为。
(4)CaF2的晶胞结构如图,若该晶胞边长为a pm,晶胞中F-半径为b pm,则Ca2+ 半径的表达式为pm(列式表示)。
下表为元素周期表的一部分,其中编号代表对应的元素。
请回答下列问题: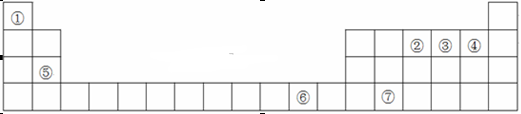
(1)写出元素⑦的基态原子的价电子排布式, 元素⑥位于元素周期表中区。
(2)元素②、③、④的第一电离能大小顺序是
(用元素符号表示)。
(3)在叶绿素a中含有元素⑤,下图是叶绿素a的部分结构,在该分子中C原子的杂化类型有,存在的化学键有。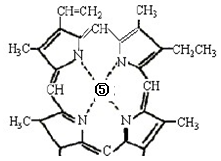
(4)②和⑥形成某种化合物的晶胞结构如图所示(每个球均表示1个原子,其中②显-3价),则其化学式为。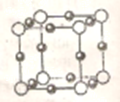
两种烃的衍生物A和B,所含碳、氢、氧的质量比均为6:1:4。完全燃烧0.1molA能生成3.6g水。B只含一个醛基,1.1gB与足量银氨溶液反应,可析出2.7gAg。
(已知Ag的相对原子质量为108)。通过计算回答以下问题:
(1)A和B的分子式分别为________________和_______________
(2)若B还能与酸发生酯化反应,且主链含3个碳原子,则其可能的结构简式有:
__________________________________________